一个体重50 kg的健康人含铁元素2 g 这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被
| 一个体重50 kg的健康人含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。 (1)经常进行Fe2+与Fe3+的转化,可表示为Fe2+ 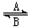 Fe3+。在过程A中,Fe2+作 剂。 Fe3+。在过程A中,Fe2+作 剂。(2)维生素C可使食物中的Fe3+转化为Fe2+,维生素C在这个反应中具有 性。 (3)某同学要检验Fe3+,向溶液中加入 (写化学式)溶液变成红色。要除去FeCl3溶液中少量的氯化亚铁,可行的办法是 (填字母)。 a.加入铜粉 b.加入铁粉 c.通入氯气 d.加入NaOH溶液 根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式 。 (4)电子工业常用30%的FeCl3 溶液腐蚀铜箔,制造印刷线路板,写出FeCl3 与金属铜反应的离子方程式 。 (5)使用过的腐蚀液会失效,但可以回收利用,某兴趣小组为了从使用过的腐蚀液中回收铜,应使用的试剂是 (填字母) a.铜粉 b.氯气 c.铁粉 d.KSCN溶液 |
参考解答
| (8分)(1)还原(1分); (2)还原(1分); (3)KSCN (1分) c (1分) 2Fe2++Cl2==2Fe3++2Cl ̄(1分) (4)2Fe3++Cu2+==2Fe2++Cu2+(1分) (5)c (2分) |
试题分析:(1)在A中铁元素的化合价由+2价升高到+3价,铁元素的化合价升高,则A中Fe2+做还原剂。 (2)由信息维生素C可使食物中的三价铁离子还原成二价铁离子,该反应中铁元素的化合价降低,则维生素C中某元素的化合价升高,即维生素C为还原剂,体现还原性。 (3)Fe3+和KSCN溶液发生特征反应,反应后溶液呈红色。氯化亚铁被强化剂氧化呈氯化铁,故选c。离子方程式为2Fe2++Cl2==2Fe3++2Cl ̄。 (4)FeCl3 与金属铜发生氧化还原反应,铜溶解,反应的离子方程式为2Fe3++Cu2+==2Fe2++Cu2+。 (5)铁的活泼性大于铜的活泼性,置换出铜一般用铁,故选c。 点评:本题属于信息习题,考查氧化还原反应中氧化剂、还原剂及氧化性、还原性,明确元素的化合价变化来分析是解答本题的关键,难度中等。 |
相似问题
PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放。通过排气管加装催化装置 可有效减少CO和NO
PM2 5细颗粒物含有的毒性物质来源之一是汽车尾气排放。通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx + CON2+ CO2,
在过量的稀硫酸溶液中加入5.6 g Fe粉 待反应完全后 再加入50 mL0.5mol·L-1 KN
在过量的稀硫酸溶液中加入5 6 g Fe粉,待反应完全后,再加入50 mL0 5mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为:“FeSO4 +KNO3 + H2SO4
下列试剂中 不能使Fe3+变为Fe2+的是( )A.SO2B.A2SC.SnD.氢溴酸
下列试剂中,不能使Fe3+变为Fe2+的是( )A.SO2B.A2SC.SnD.氢溴酸
钛被誉为“21世纪金属”。工业冶炼钛的第一步反应为:TiO2+2C+2Cl2 TiCl4+2
钛被誉为“21世纪金属”。工业冶炼钛的第一步反应为:TiO2+2C+2Cl2TiCl4+2CO。下列关于该反应的说法正确的是A.TiO2是氧化剂B.氧化剂与还原剂的物质的
根据下列反应: (1) 2Fe3+ +2I- = 2Fe2+ +I2 (2) Br2 + 2Fe2
根据下列反应: (1) 2Fe3+ +2I- = 2Fe2+ +I2(2) Br2 + 2Fe2+ = 2Br-+2Fe3+,判断离子的还原性由强到弱的顺序是( )A.Br- > I-> Fe2+ B.I












