在过量的稀硫酸溶液中加入5.6 g Fe粉 待反应完全后 再加入50 mL0.5mol·L-1 KN
| 在过量的稀硫酸溶液中加入5.6 g Fe粉,待反应完全后,再加入50 mL0.5mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为: “ FeSO4 + KNO3 + H2SO4= K2SO4 + Fe2(SO4)3+ NxOy + H2O”,则对该反应的下列说法正确的是
|
参考解答
| D |
试题分析:设还原产物中N的化合价为a,由电子守恒可得, 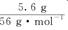 ×1=0.5 mol·L-1×50×10-3 L×(5-a),解得a=1,所以还原产物为N2O,所以A错误;由得失电子守恒和原子守恒配平化学方程式得8FeSO4+2KNO3+5H2SO4=K2SO4+4Fe2(SO4)3+N2O+5H2O,所以D正确,由化学方程式可知氧化产物和还原产物的物质的量之比为4∶1,所以B错误,反应过程中转移的电子数为0.1×6.02×1023个,所以D错误。 ×1=0.5 mol·L-1×50×10-3 L×(5-a),解得a=1,所以还原产物为N2O,所以A错误;由得失电子守恒和原子守恒配平化学方程式得8FeSO4+2KNO3+5H2SO4=K2SO4+4Fe2(SO4)3+N2O+5H2O,所以D正确,由化学方程式可知氧化产物和还原产物的物质的量之比为4∶1,所以B错误,反应过程中转移的电子数为0.1×6.02×1023个,所以D错误。点评:本题利用了电子得失守恒的原理解决了计算问题。在氧化还原反应的计算和配平中,电子得失守恒运用得很多,需要学生熟练掌握。 |
相似问题
下列试剂中 不能使Fe3+变为Fe2+的是( )A.SO2B.A2SC.SnD.氢溴酸
下列试剂中,不能使Fe3+变为Fe2+的是( )A.SO2B.A2SC.SnD.氢溴酸
钛被誉为“21世纪金属”。工业冶炼钛的第一步反应为:TiO2+2C+2Cl2 TiCl4+2
钛被誉为“21世纪金属”。工业冶炼钛的第一步反应为:TiO2+2C+2Cl2TiCl4+2CO。下列关于该反应的说法正确的是A.TiO2是氧化剂B.氧化剂与还原剂的物质的
根据下列反应: (1) 2Fe3+ +2I- = 2Fe2+ +I2 (2) Br2 + 2Fe2
根据下列反应: (1) 2Fe3+ +2I- = 2Fe2+ +I2(2) Br2 + 2Fe2+ = 2Br-+2Fe3+,判断离子的还原性由强到弱的顺序是( )A.Br- > I-> Fe2+ B.I
检验海带中碘元素的实验中 发生如下反应:2H++2I-+H2O2=I2+2H2O 下列对该反应的叙述
检验海带中碘元素的实验中,发生如下反应:2H++2I-+H2O2=I2+2H2O,下列对该反应的叙述中不正确的是( )。A.I2为氧化产物B.H2O2既作氧化剂又作还
离子在一定条件下可以把Mn2+离子氧化为 若反应后离子变为离子 又知反应中氧的化合价不发生变化 且氧
离子在一定条件下可以把Mn2+离子氧化为,若反应后离子变为离子,又知反应中氧的化合价不发生变化,且氧化剂与还原剂的离子数之比为5∶2,则n的值是()A












