离子在一定条件下可以把Mn2+离子氧化为 若反应后离子变为离子 又知反应中氧的化合价不发生变化 且氧
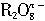 离子在一定条件下可以把Mn2+离子氧化为 离子在一定条件下可以把Mn2+离子氧化为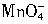 ,若反应后 ,若反应后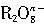 离子变为 离子变为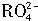 离子, 离子,又知反应中氧的化合价不发生变化,且氧化剂与还原剂的离子数之比为5∶2,则n的值是( )
|
参考解答
| B |
试题分析:根据题意,Mn元素的化合价从+2价升高到+7价,失去5个电子。设氧化剂中R的化合价是x,则根据电子的得失守恒可知,2×5=5×(x-6)×2,解得x=7,因此n=8×2-2×7=2,答案选B。 点评:该题是中等难度的试题,也是高考中的常见题型和重要的考点之一,侧重对基础知识的巩固与训练的,难度不大。该题的关键是准确判断出有关元素的化合价变化情况,然后根据有关概念以及电子的得失守恒灵活运用即可。 |
相似问题
①14Cu2++5FeS2+12H2O = 7Cu2S + 5Fe2+ + 24H++3SO42-②
①14Cu2++5FeS2+12H2O = 7Cu2S + 5Fe2+ + 24H++3SO42-②Mn2+ + S2O82- + H2O— MnO4- + SO42-+ H+对上述两个反应判断正确的是( )A.①②
NaNO2有像食盐一样的外观和咸味 它可将正常的血红蛋白变为高铁血红蛋白 使血红蛋白中的铁元素由二价
NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力,美蓝是亚硝酸盐中毒的有效
下列氧化还原反应中 电子得失情况表示不正确的是A.B.C.D.
下列氧化还原反应中,电子得失情况表示不正确的是A.B.C.D.
已知反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 据此判断下列说法正确( )
已知反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,据此判断下列说法正确()A.KCl为还原产物B.HCl全部发生氧化反应C.该反应表明氧化性KClO3比Cl2强D.1
已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓
已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是A.该反应中Fe2+是还原剂,O2是还原












