xR2++yH++O2 mR3++2H2O中 对m和R3+判断正确的是A.m=4 R2+是氧化剂B.
xR2++yH++O2
|
参考解答
| C |
试题分析:由化合价的变化可以看到:R2+→R3+化合价升高,所以R2+做还原剂,R3+是氧化产物; O2→H2O氧元素的化合价从0→-2,所以氧气是氧化剂,水是还原产物;由R 原子守恒得:x=m 由H原子守恒得:y=4;由电荷守恒得:2x+y=3m,由此可得m=x=y=4,故选C。 点评:本题考查的是氧化还原反应知识,学生要熟悉氧化还原反应的概念规律,此类问题很容易的得到解决。 A、氧化性、还原性的判断 ①氧化性是指得电子的能力,还原性是指失电子的能力。 ②氧化性、还原性的强弱取决于得失电子的难易程度,与得失电子的多少无关。 氧化剂得电子,化合价降低,具有较强氧化性;氧化产物具有较弱氧化性;(因此可判断物质的氧化性强弱) 还原剂失电子,化合价升高,具有较强还原性;还原产物具有较弱还原性;(因此可判断物质的还原性强弱) B、相等规律: 在任何氧化还原反应中,氧化剂得到电子的总数与还原剂失去电子的总数相等。此规律应用于解氧化还原反应的计算题、氧化还原反应方程式的配平。 |
相似问题
某含Cr2O72-废水用硫酸亚铁铵[(NH4)2 Fe(SO4)2?6H2O]处理 反应中铁元素和铬
某含Cr2O72-废水用硫酸亚铁铵[(NH4)2 Fe(SO4)2?6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3。不考虑处理
(9分)利用氧化还原反应原理配平⑴ NH3 + Cl2 N2 + NH4C
(9分)利用氧化还原反应原理配平⑴ NH3 + Cl2N2 + NH4Cl ⑵ FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NO↑+
(10分)含硫化合物的种类很多 现有SO2 Na2SO3 H2SO4 CuSO4这4种常见的含硫化合
(10分)含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4这4种常见的含硫化合物。回答下列问题:(1)为进一步减少SO2的污染并变废为宝,我国正在探索
用0.1 mol/L的Na2SO3溶液30 mL 恰好将2×10-3 mol XO4-还原 则元素X
用0 1 mol L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物中的化合价是()A.+4 B.+3C.+2 D.+1
在化学分析中草酸(H2C2O4)是重要的还原剂 已知20.00 mL 0.100 mol·L-1 V
在化学分析中草酸(H2C2O4)是重要的还原剂,已知20 00 mL 0 100 mol·L-1 VO2+离子恰好将20 00 mL 0 050 mol·L-1 H2C2O4完全氧化成CO2,VO2+被


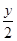 ,R3+是还原剂
,R3+是还原剂









