(9分)利用氧化还原反应原理配平⑴ NH3 + Cl2 N2 + NH4C
| (9分)利用氧化还原反应原理配平 ⑴ NH3 + Cl2 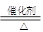 N2 + NH4Cl N2 + NH4Cl ⑵ FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NO↑+ H2O 在(2)的反应中 元素被氧化, 是还原产物,该反应中体现硫酸的 性。当反应中有0.3mol电子发生转移时,生成NO的体积(标准状况) L。 |
参考解答
| (1)8 3 1 6 (2分) (2)6 2 4 3 2 4(2分) Fe ; NO ; 酸性;(各1分) 2.24 (2分) |
⑴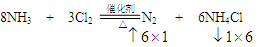 ⑵  Z转移6mole- Z转移6mole- |
相似问题
(10分)含硫化合物的种类很多 现有SO2 Na2SO3 H2SO4 CuSO4这4种常见的含硫化合
(10分)含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4这4种常见的含硫化合物。回答下列问题:(1)为进一步减少SO2的污染并变废为宝,我国正在探索
用0.1 mol/L的Na2SO3溶液30 mL 恰好将2×10-3 mol XO4-还原 则元素X
用0 1 mol L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物中的化合价是()A.+4 B.+3C.+2 D.+1
在化学分析中草酸(H2C2O4)是重要的还原剂 已知20.00 mL 0.100 mol·L-1 V
在化学分析中草酸(H2C2O4)是重要的还原剂,已知20 00 mL 0 100 mol·L-1 VO2+离子恰好将20 00 mL 0 050 mol·L-1 H2C2O4完全氧化成CO2,VO2+被
铁溶于一定浓度的硝酸溶液时 发生反应的离子方程式为:aFe+bNO3-+cH+=dFe2++fFe3
铁溶于一定浓度的硝酸溶液时,发生反应的离子方程式为:aFe+bNO3-+cH+=dFe2++fFe3++gNO↑+hNO2↑+kH2O下列有关推断中,不正确的是A.2d+3f=
某金属的硝酸盐受热分解生成NO2 O2和该金属的氧化物。已知NO2和O2的分子个数比为4:1 则在分
某金属的硝酸盐受热分解生成NO2、O2和该金属的氧化物。已知NO2和O2的分子个数比为4:1,则在分解过程中该金属的化合价将( )A.无法确定B.升高C.不变D.降低












