(10分)含硫化合物的种类很多 现有SO2 Na2SO3 H2SO4 CuSO4这4种常见的含硫化合
| (10分)含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4这4种常见的含硫化合物。回答下列问题: (1)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2 。写出该反应的化学方程式: 。 (2)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应: 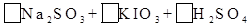 — — 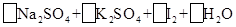 ①配平上面的氧化还原反应方程式.将化学计量数填入方框中。 ②其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘单质是 mol。 (3) 向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成。此沉淀是
 |
参考解答
(1)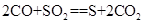 (2分) (2分)(2)① 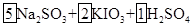 = =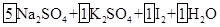 (2分) (2分)② 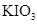 ,(1分) 0.5 (1分) ,(1分) 0.5 (1分)(3) A (2分) (4) 无明显现象 (2分) |
(1)CO还原SO2的生成物应该是CO2和三氧化硫,方程式为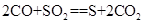 。 。(2)①反应中亚硫酸钠是还原剂,S的化合价从+4价升高到+6价,变化2个单位。碘酸钾是氧化剂I的化合价从+5价降低到0价,变化5个单位,所以根据电子的得失守恒可知,还原剂和氧化剂的物质的量之比是5︰2,所以方程式为 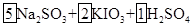 = =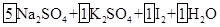 。 。②根据方程式可知,反应中有5 mol电子转移,则生成的碘单质是0.5mol。 (3)铁离子具有氧化性,能把SO2氧化生成硫酸,所以沉淀是硫酸钡沉淀,答案选A。 (4)如果钝化,则铁被氧化膜覆盖,不能与硫酸铜发生反应,所以现象应该是无明显现象。 |
相似问题
用0.1 mol/L的Na2SO3溶液30 mL 恰好将2×10-3 mol XO4-还原 则元素X
用0 1 mol L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物中的化合价是()A.+4 B.+3C.+2 D.+1
在化学分析中草酸(H2C2O4)是重要的还原剂 已知20.00 mL 0.100 mol·L-1 V
在化学分析中草酸(H2C2O4)是重要的还原剂,已知20 00 mL 0 100 mol·L-1 VO2+离子恰好将20 00 mL 0 050 mol·L-1 H2C2O4完全氧化成CO2,VO2+被
铁溶于一定浓度的硝酸溶液时 发生反应的离子方程式为:aFe+bNO3-+cH+=dFe2++fFe3
铁溶于一定浓度的硝酸溶液时,发生反应的离子方程式为:aFe+bNO3-+cH+=dFe2++fFe3++gNO↑+hNO2↑+kH2O下列有关推断中,不正确的是A.2d+3f=
某金属的硝酸盐受热分解生成NO2 O2和该金属的氧化物。已知NO2和O2的分子个数比为4:1 则在分
某金属的硝酸盐受热分解生成NO2、O2和该金属的氧化物。已知NO2和O2的分子个数比为4:1,则在分解过程中该金属的化合价将( )A.无法确定B.升高C.不变D.降低
(1)工业上用碳在高温下与二氧化硅反应制取粗硅。反应的化学方程式为: SiO2+2CSi+2CO↑
(1)工业上用碳在高温下与二氧化硅反应制取粗硅。反应的化学方程式为:SiO2+2CSi+2CO↑,在该反应中氧化剂是_____________________________,被氧化的物












