(15分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。(1)与氯元素同族的短周期元素的原子结
| (15分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。 (1)与氯元素同族的短周期元素的原子结构示意图为 。 (2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。 a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性 c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性 (3)工业上,通过如下转化可制得KClO3晶体: NaCl溶液 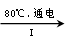 NaClO3溶液 NaClO3溶液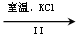 KClO3晶体 KClO3晶体①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。 ②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。 (4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。 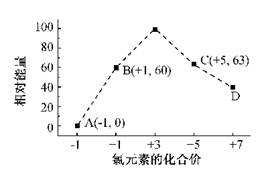 ①D是 (填离子符号)。 ②B→A+C反应的热化学方程式为 (用离子符号表示)。 |
参考解答
⑴ 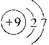 ⑵b、c ⑵b、c⑶①1NaCl+3H2O=1NaClO3+3H2↑ ②复分解反应 室温下,氯酸钾在水中的溶解度明显小于其它晶体 ⑷①ClO4- ②3ClO-(aq)=ClO3- (aq)+2Cl-(aq),ΔH=-117KJ·mol-1 |
试题分析:⑴与氯元素同族的短周期元素为氟元素,其原子结构示意图为 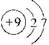 。 。⑵非金属单质的氧化性、非金属元素的氢化物的稳定性能作为判断非金属性递变规律的判断依据,而非金属单质的熔点(物理性质)、非金属元素的氢化物的酸性(没有相似的递变规律)不能作为判断非金属性递变规律的判断依据。 ⑶①首先分析80 ℃下电解NaCl溶液在阳极产生NaClO3,在阴极产生H2,然后根据氧化还原反应化合价升降法将其配平。 ②Ⅱ中所发生的反应为:NaClO3+KCl=KClO3↓+NaCl,属于复分解反应;由于室温下,氯酸钾在水中的溶解度明显小于其它晶体,故该反应过程能析出KClO3晶体而无其它晶体析出。 ⑷①据图知D对应的化合价为+7,则其含氯的离子为ClO4- 。 ②据图知A为Cl-,B为ClO-,C为ClO3- ,则B→A+C反应的化学方程式(并标出状态)为:3ClO-(aq)=ClO3- (aq)+2Cl-(aq),反应放出热量:60×3-63×1-0×2=117KJ/mol,故其反应热ΔH=-117KJ/mol,综上便可写出完整的热化学方程式。 |
相似问题
【物质结构与性质】X Y Z M N Q为元素周期表前四周期的六种元素。其中X原子核外的M层中只有两
【物质结构与性质】X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地
(15分)【化学—选修3:物质结构与性质】 a b c d f五种前四周期元素 原子序数依次增大;a
(15分)【化学—选修3:物质结构与性质】 a、b、c、d、f五种前四周期元素,原子序数依次增大;a、b、c三种元素的基态原子具有相同的能层和能级,第一电
下列各组顺序的排列不正确的是( )A.原子半径:Na>Mg>Al>HB.热稳定性: HC l<
下列各组顺序的排列不正确的是( )A.原子半径:Na>Mg>Al>HB.热稳定性: HC l<H2S<PH3C.酸性强弱:H2SiO3<H2CO3<H3PO4D.氧化性:K+<Na+<Mg2+<Al3+
根据元素周期表 填写下列空白:(1)最活泼的非金属元素位于周期表中第 周期第 族 第
根据元素周期表,填写下列空白:(1)最活泼的非金属元素位于周期表中第周期第族、第纵行。某元素B含有8个质子、10个中子,用表示B原子的组成,(2)在
(14分)下图是元素周期表的一部分① ② ③④
(14分)下图是元素周期表的一部分①②③④⑤⑥⑦⑧⑨⑩(1)元素⑨的价电子轨道表示式为,元素⑩的次外层电子数为个。(2)如果在温度接近373K时,根据M












