[物质结构与性质]磁性材料氮化铁镍合金可用Fe(NO3)3 Ni(NO3)2 丁二酮肟 氨气 氮气
| [物质结构与性质] 磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。 (1) 基态Ni原子的价电子排布式是________。 (2) 丁二酮肟(结构简式如右图所示)中碳原子的杂化方式为________。 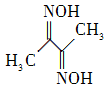 (3) NH3的沸点高于PH3,其主要原因是____。 (4) 与N3-离子具有相同电子数的三原子分子的空间构型是________。 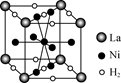 (5) 向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,则1 mol[Ni(NH3)6]2+含有的σ键为________mol。 (6) 右图是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为________。 |
参考解答
(1) 3d84s2 (2) sp2、sp3 (3) NH3分子间存在氢键 (4) V型 (5) 24 (6) 3 mol或3NA |
试题分析:(2)结构中碳原子均形成单键,为sp3杂化;(3)氨气分子间存在氢键,所以其溶沸点高;(4)该微粒为10电子微粒,三原子分子为水,氧原子为sp3杂化,空间结构为V型;(5)氨气中氮原子与Ni形成配位键,共6个,每个氨气分子中形成3个氮氢键,共有6+3×6=24mol; (6)晶胞结构中原子数目:La 8×1/8=1 H 8×1/4+2×1/2=3 所以含1 mol La的合金可吸附H2的数目为3mol。 |
相似问题
A B C为三种短周期元素 A B同周期 A C的最低价离子分别为A2- C- B2+与C-C具有相
A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,B2+与C-C具有相同的电子层结构,下列叙述一定不正确的是A.离子半径B.它们
(8分)已知A B C D E是短周期中的5元素 它们的原子序数依次增大。A是原子半径最小的元素 C
(8分)已知A、B、C、D、E是短周期中的5元素,它们的原子序数依次增大。A是原子半径最小的元素,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数
(15分)X Y Z W为前四周期的元素 其原子序数依次增大。Y元素最外层电子数是其内层电子数的3倍
(15分)X、Y、Z、W为前四周期的元素,其原子序数依次增大。Y元素最外层电子数是其内层电子数的3倍。X与Y形成的常见化合物多于两种。Z与Y、W分处不同周期,
(12分) A B C D E F G七种元素 试按下列所给条件推断 ①A B C是同一周期的金属
(12分) A、B、C、D、E、F、G七种元素,试按下列所给条件推断,①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,
第三周期第ⅣA族的元素原子序数是 。 钠元素的原子序数为11 相邻的同族元素的原子序数是
第三周期第ⅣA族的元素原子序数是 。钠元素的原子序数为11,相邻的同族元素的原子序数是 。短周期元素中,族序数=周期序数的元素有












