(15分)X Y Z W为前四周期的元素 其原子序数依次增大。Y元素最外层电子数是其内层电子数的3倍
| (15分)X、Y、Z、W为前四周期的元素,其原子序数依次增大。Y元素最外层电子数是其内层电子数的3倍。X与Y形成的常见化合物多于两种。Z与Y、W分处不同周期,且Z的离子是构成叶绿素中重要大环有机物的中心离子。W被称为继铁、铝之后的第三金属。请根据上述信息回答下列问题: (1)请画出X基态原子价电子的电子排布图: 。 (2)X、Y、Z三种元素第一电离能由大到小顺序是: (写元素符号)。 (3)X最高价氧化物对应水化物中X的杂化方式是: 。 (4)X气态氢化物分子的空间构型为: ,X的气态氢化物与Y的气态氢化 物比较沸点高的是: (写分子式),键角较大的是 (写分子式)。 (5)W晶体的晶胞如图所示,其配位数为: 。假设该晶胞中的钛原子的直径为a pm, Na为阿伏伽德罗常数,请列式表示该晶体的密度为 g/cm3。 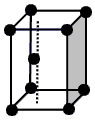 |
参考解答
| ⑴ 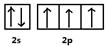 (2’) (2’)⑵N>O>Mg(2’) ⑶sp2(1’) ⑷三角锥形,H2O,NH3(各2’) ⑸12(2’), 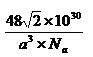 (2’) (2’) |
试题分析:X、Y、Z、W为前四周期的元素,其原子序数依次增大,Y元素最外层电子数是其内层电子数的3倍,则Y为O元素,X与Y形成的常见化合物多于两种,则X为N元素,Z的离子是构成叶绿素中重要大环有机物的中心离子,Z为Mg元素,W被称为继铁、铝之后的第三金属,则W为Ti元素。 (1)x为N元素,基态原子价电子为2s22p3,所以电子排布图为: 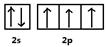 (2)N元素基态原子2p轨道排布了3个电子,半充满,为稳定状态,则N元素的第一电离能大于O元素的第一电离能,所以X、Y、Z三种元素第一电离能由大到小顺序是:N>O>Mg (3)X最高价氧化物对应水化物为HNO3,N原子形成了3个σ键,不含孤对电子,所以N原子的杂化方式为sp2杂化。 (4)X气态氢化物为NH3,NH3分子的空间构型为三角锥形;NH3在常温下为气体,Y的气态氢化物为H2O,沸点为100℃,所以H2O的沸点更高;NH3中N原子和H2O中O原子都是sp3杂化,N原子有一对孤对电子,O原子有二对孤对电子,对成键电子对的排斥作用更强,所以NH3的键角较大。 (5)钛晶体为六方最密堆积,所以配位数为12;根据晶胞示意图和均摊法可知一个晶胞含Ti原子:8×1/8+1=2,则一个晶胞的质量为2×48/Na g,根据数学知识可求出一个晶胞的体积为 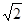 a3×10-30cm3,所以该晶体的密度2×48/Na÷ a3×10-30cm3,所以该晶体的密度2×48/Na÷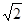 a3×10-30 g/cm3= a3×10-30 g/cm3=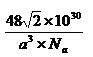 g/cm3 g/cm3 |
相似问题
(12分) A B C D E F G七种元素 试按下列所给条件推断 ①A B C是同一周期的金属
(12分) A、B、C、D、E、F、G七种元素,试按下列所给条件推断,①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,
第三周期第ⅣA族的元素原子序数是 。 钠元素的原子序数为11 相邻的同族元素的原子序数是
第三周期第ⅣA族的元素原子序数是 。钠元素的原子序数为11,相邻的同族元素的原子序数是 。短周期元素中,族序数=周期序数的元素有
下图是元素周期表的一部分 下列说法正确的是( )A.可在灰色区域“甲”中寻找催化剂B.离子
下图是元素周期表的一部分,下列说法正确的是( )A.可在灰色区域“甲”中寻找催化剂B.离子半径:W-﹥Y3-﹥X+C.气态氢化物的稳定性:Z﹥WD.工业上电解
V W X Y Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素 Y Z组成的气态化
V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成的气态化合物M的水溶液呈碱性,W的单质在X2中燃烧产物可使品红
已知A B C D E是短周期中原子序数依次增大的5种主族元素 其中A的原子最外层电子数是次外层电子
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A的原子最外层电子数是次外层电子数的2倍,元素B的原子最外层电子数是其电子层数的3倍












