(8分)已知A B C D E是短周期中的5元素 它们的原子序数依次增大。A是原子半径最小的元素 C
| (8分)已知A、B、C、D、E是短周期中的5元素,它们的原子序数依次增大。A是原子半径最小的元素,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳。回答下列问题: (1)元素D在周期表中的位置是 。 (2)画出E的阴离子的结构示意图: 。 (3)写出一种由A、B、C、D四种元素组成的离子化合物的化学式: 。 写出一种由A、C、D三种元素组成的共价化合物的化学式: 。 (4)将9 g B单质在足量的D单质中燃烧,所得气体通入1 L 1 mol·L-1NaOH溶液中, 完全吸收后,溶液中大量存在的阴离子是 。 |
参考解答
| (8分) (1)第2周期ⅥA族 (1分) (2) 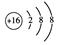 (1分) (1分)(3) NH4HCO3或(NH4)2CO3(2分) HNO3或HNO2(2分) (4) CO32-和 HCO3-(2分,缺一项不得分) |
试题分析:A是原子半径最小的元素,所以A是H元素;,B原子的最外层电子数是内层电子数的2倍,所以B最外层电子是4个,有2层电子,B是C元素; E的单质为黄色晶体,易溶于二硫化碳,E是S元素;E元素与D元素同主族,则D是O元素;C、D在元素周期表中处于相邻的位置,则C是N元素。根据以上分析得: (1) 元素D在周期表中的位置是第2周期ⅥA族; (2)E的阴离子即S2-的结构示意图: 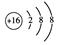 (3)由A、B、C、D四种元素组成的离子化合物是NH4HCO3或(NH4)2CO3;由A、C、D三种元素组成的共价化合物是HNO3或HNO2; (4)9 g C单质在足量的氧气中燃烧,生成0.75mol的CO2,与1mol的NaOH反应生成的产物可通过计算判断。设产物中NaHCO3、Na2CO3的物质的量分别是x、y,根据元素守恒得x+2y=1mol,x+y=0.75mol,解得x=0.5mol,y=0.25mol,所以完全吸收后,溶液中大量存在的阴离子是CO32-和 HCO3-。 |
相似问题
(15分)X Y Z W为前四周期的元素 其原子序数依次增大。Y元素最外层电子数是其内层电子数的3倍
(15分)X、Y、Z、W为前四周期的元素,其原子序数依次增大。Y元素最外层电子数是其内层电子数的3倍。X与Y形成的常见化合物多于两种。Z与Y、W分处不同周期,
(12分) A B C D E F G七种元素 试按下列所给条件推断 ①A B C是同一周期的金属
(12分) A、B、C、D、E、F、G七种元素,试按下列所给条件推断,①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,
第三周期第ⅣA族的元素原子序数是 。 钠元素的原子序数为11 相邻的同族元素的原子序数是
第三周期第ⅣA族的元素原子序数是 。钠元素的原子序数为11,相邻的同族元素的原子序数是 。短周期元素中,族序数=周期序数的元素有
下图是元素周期表的一部分 下列说法正确的是( )A.可在灰色区域“甲”中寻找催化剂B.离子
下图是元素周期表的一部分,下列说法正确的是( )A.可在灰色区域“甲”中寻找催化剂B.离子半径:W-﹥Y3-﹥X+C.气态氢化物的稳定性:Z﹥WD.工业上电解
V W X Y Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素 Y Z组成的气态化
V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成的气态化合物M的水溶液呈碱性,W的单质在X2中燃烧产物可使品红












