某矿石由MgO Fe2O3 CuO和SiO2组成 用它制备氢氧化镁的流程示意图如图所示:(1)溶液A
某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图所示: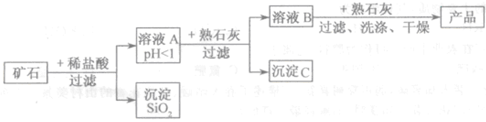 (1)溶液A中共含有 种阳离子; (2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可允许的范围为 ;
(3)溶液B中一定含有的溶质为 (填化学式); (4)写出溶液B中加入熟石灰,生成产品的化学方程式: 。 |
参考解答
| (1)4; (2)6.7-8.6; (3)MgCl2和CaCl2; (4)MgCl2+Ca(OH)2=Mg(OH)2↓+ CaCl2。 |
试题分析:(1)矿石成分中的SiO2(不反应)。MgO、Fe2O3、CuO三种物质和与稀盐酸反应后会形成镁离子、铁离子与铜离子三种阳离子,由于溶液A的PH小于1,所以还含有大量的氢离子;共计四种阳离子。 (2)从工艺图中可知,最终产品为氢氧化镁。所以加入熟石灰后,应使铁离子与铜离子全部形成沉淀。所以其pH要大于6.7(两种离子均完全沉淀);pH要小于为8.6(镁离子还没有形成沉淀); (3)溶液A加入熟石灰后,溶液中的铁离子与铜离子已全部除去,所以溶液B中的阳离子为镁离子与钙离子,因此溶液B中的溶质为MgCl2和CaCl2。 (4)溶液B中含有的氯化镁和加入的熟石灰(氢氧化钙)反应,化学方程式为:MgCl2+Ca(OH)2=Mg(OH)2↓+ CaCl2 点评:本题涉及的反应较多,可从离子的角度来分析。 |
相似问题
我国化学家侯德榜发明了联合制碱法 其生产纯碱的产品和副产品氯化铵的工艺流程如图所示:(1)NH3溶于
我国化学家侯德榜发明了联合制碱法,其生产纯碱的产品和副产品氯化铵的工艺流程如图所示:(1)NH3溶于水得到氨水,将无色酚酞溶液滴入氨水中,溶液呈
(6分)某兴趣小组从铜器上取下绿色粉末 设计如下实验步骤进行探究铜绿的组成。⑴写出:B物质的化学式
(6分)某兴趣小组从铜器上取下绿色粉末,设计如下实验步骤进行探究铜绿的组成。⑴写出:B物质的化学式;铜绿的组成元素。⑵我国古代有“曾青得铁则化为铜
金属及金属材料在日常生活中应用广泛。(1)下列生活用品中 主要利用金属导热性的是
金属及金属材料在日常生活中应用广泛。(1)下列生活用品中,主要利用金属导热性的是(填字母序号)。(2)铁生锈的条件是铁与 同时接触。工业上
下表列出了除去物质中所含少量杂质的方法 其中错误的是( )选项物质所含杂质除去杂质的方法ACOCO
下表列出了除去物质中所含少量杂质的方法,其中错误的是( )选项物质所含杂质除去杂质的方法ACOCO2通入足量的氢氧化钠溶液,干燥BNaCl泥沙加入足量的
(1)下列三种金属被发现 使用的先后顺序为:铜 铁 铝。金属大规模被使用的先后顺序跟(选填字母)
(1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝。金属大规模被使用的先后顺序跟(选填字母)(A 地壳中金属元素的含量B 金属的导电性C 金属的活动












