(8分)某学生为了探究锌与盐酸反应过程中的速率变化 他在100mL稀盐酸中加入足量的锌粉 用带刻度的
(8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用带刻度的集气瓶排水法收集氢气,每隔1分钟记录一次数据(累计值):
造成这种变化的主要因素是 ;从3~5分钟时间段内,产生氢气的速率是如何变化的?答: 。造成这种变化的主要因素是 。 (2)在盐酸中分别加入等体积的下列溶液,能减缓反应速率而又不减少产生氢气的量的是 。 A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液 (3)在0~1、1~2、2~3、3~4、4~5分钟五个时间段中,反应速率最大的时间段的盐酸的反应速率为 (设溶液体积不变,上述气体体积为标况下数据)。 |
参考解答
| (1)反应速率逐渐增大(1分);锌与盐酸反应放热,使溶液温度升高(1分); 反应速率逐渐减小(1分);随着反应进行,c(H+)逐渐减小(1分)。 (2)A 、B (2分) (3)0.1 mol/(L?min)(2分,单位错、漏得0分) |
| (1)根据表中数据可知,在0~1、1~2、2~3内生成的氢气分别是(ml)50、70、112,所以反应速率逐渐增大,这是由于锌与盐酸反应放热,使溶液温度升高,反应速率增大。在3~4、4~5内生成的氢气分别是(ml)58、20,所以反应速率逐渐减小,这是由于随着反应进行,c(H+)逐渐减小,反应速率逐渐减小。 (2)稀释能降低氢离子浓度,但不减少氢离子的物质的量,所以A正确。氯化钠溶液也是相当于稀释,B正确。碳酸钠能消耗氢离子,导致生成的氢气减少,C不正确,锌能置换出铜,从而构成原电池,加快反应速率,D不正确。答案选AB。 (3)根据(1)可知,在2~3内生成的氢气最多,氢气的物质的量是0.005mol,消耗盐酸是0.01mol,所以盐酸的反应速率是 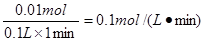 。 。 |
相似问题
(12分)某学习小组为证明并观察铜与稀HNO3反应的产物是NO 设计了如下图所示的实验装置。请你根据
(12分)某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置。请你根据他们的思路,回答有关的问题。(一)实验仪器:大试管
某实验小组用下列装置进行乙醇催化氧化的实验。(1)实验过程中铜网出现黑色和红色交替的现象 请写出相应
某实验小组用下列装置进行乙醇催化氧化的实验。(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式 、。在不断鼓入空气的情况下,熄
某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去)。(1)写出实验室制取氨气
某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去)。(1)写出实验室制取氨气的化学方程式: _____________________________。
已知在pH为4-5的环境中 Cu2+几乎不水解 而Fe3+几乎完全水解。某学生欲用电解纯净的CuSO
已知在pH为4-5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净的CuSO4溶液的方法,根据电极上析出铜的质量以及电极上产生气体的体积
某种催化剂为铁的氧化物。化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样
某种催化剂为铁的氧化物。化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶液后












