电解装置如图所示 电解槽内装有KI及淀粉溶液 中间用阴离子交换膜隔开.在一定的电压下通电 发现左侧溶
| 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅. 已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法不正确的是( )
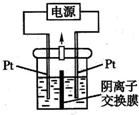 |
参考解答
| A.左侧溶液变蓝色,生成I2,左侧电极为阳极,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,故A正确; B.一段时间后,蓝色变浅,发生反应3I2+6OH-=IO3-+5I-+3H2O,中间为阴离子交换膜,右侧I-、OH-通过阴离子交换膜向左侧移动,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,故右侧溶液中含有IO3-,故B正确; C.左侧电极为阳极,电极反应为:2I--2e-=I2,同时发生反应3I2+6OH-=IO3-+5I-+3H2O,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,故总的电极反应式为:KI+3H2O
D.如果用阳离子交换膜代替阴离子交换膜,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,保证两边溶液呈电中性,左侧多余K+通过阳离子交换膜迁移至阴极,左侧生成I2,右侧溶液中有KOH生成,碘单质与KOH不能反应,总反应相当于:2KI+2H2O
故选D. |
相似问题
将0.1L含有0.02mol CuSO4和0.01mol NaCl的水溶液用惰性电极电解.电解一段时
将0 1L含有0 02molCuSO4和0 01molNaCl的水溶液用惰性电极电解.电解一段时间后,某电极的质量增加了0 64g.下列说法正确的是( )A.质量增加的电极为
下列关于电解的说法正确的是 [ ]A. 工业上通常用电解饱和食盐水生产金属钠 电解熔融氯化铝
下列关于电解的说法正确的是 [ ]A 工业上通常用电解饱和食盐水生产金属钠,电解熔融氯化铝冶炼铝 B 电镀时,通常把待镀的金属制品做阳极 C 电解法精
以惰性电极电解100mL 0.1mol?L-1CuSO4溶液.若阳极上产生气体的物质的量为0.01m
以惰性电极电解100mL0 1mol?L-1CuSO4溶液.若阳极上产生气体的物质的量为0 01mol,则阴极上析出Cu的质量为( )A.0 32gB.0 64gC.1 28gD.2 56g
用石墨作电极电解2 mol·L-1NaCl和1 mol·L-1MgSO4混合溶液时 下列曲线合理的是
用石墨作电极电解2 mol·L-1NaCl和1 mol·L-1MgSO4混合溶液时,下列曲线合理的是 [ ]A B C D
电解KOH溶液时 若阴 阳两极分别为碳和铁 当生成0.1mol Fe(OH)3沉淀时 共消耗amol
电解KOH溶液时,若阴、阳两极分别为碳和铁,当生成0 1molFe(OH)3沉淀时,共消耗amolH2O,产生bLH2(标准状况).则a和b分别为( )A.a=0 25,b=2 2












