已知X Y Z W四种短周期元素的原子序数依次增大 其中X与Y Z W所形成的常见化合物在常温下均呈
| 已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中W与Z左右相邻,Y的最高价氧化物对应的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题: (1)Z的离子结构示意图是______; (2)Z2W2分子中,W与Z均满足8e-稳定结构,则Z2W2的电子式为______ (3)YW3 在常温下是一种淡黄色的液体,与水按一定的物质的量之比反应,生成两种物质,其中一种具有漂白性,写出该反应的方程式______;该反应说明其中Y和W中非金属性较强的是______(填元素的符号) |
参考解答
| X与Y、Z、W所形成的常见化合物在常温下均呈气态,,多为氢化物,则X为H元素,Y的最高价氧化物对应的水化物与其氢化物反应生成盐,则Y应为N元素,形成的化合物NH4NO3,Y的核电荷数为7,与W的最外层电子数相同,则W可能为F,也可能为Cl元素,如W为F元素,则Z为O元素,Z对应的氢化物为H2O,在常温下为液体,不成立,所以W为Cl元素,Z为S元素, (1)Z为S元素,对应的S2-离子有16个质子,18个电子,结构示意图为 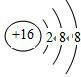 , 故答案为:  ; (2)Z2W2分子为S2Cl2,W与Z均满足8e-稳定结构,则电子式为 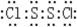 ,故答案为: 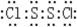 ; (3)YW3为NCl3,与水按一定的物质的量之比反应,生成两种物质,其中一种具有漂白性,具有漂白性的物质为HClO,则反应的化学方程式为NCl3+3H2O=NH3+3HClO,说明N元素的非金属性比Cl强, 故答案为:NCl3+3H2O=NH3+3HClO;N. |
相似问题
A B C三种元素的原子具有相同的电子层数 且B的核外电子数比A多2个 C的质子数比B多4个 1mo
A、B、C三种元素的原子具有相同的电子层数,且B的核外电子数比A多2个,C的质子数比B多4个,1molA的单质与酸反应,能置换出1gH2,这时,A转化为具有氖原子
有A B C D四种短周期元素 它们的原子序数由A到D依次增大 已知A和B原子有相同的电子层数 且A
有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的一种单质硬度很大,C燃烧时使火焰呈现黄色,C的单质在
A B C D E F六种主族元素分布在三个短周期 它们的原子序数依次增大.其中B与C位于同二周期
A、B、C、D、E、F六种主族元素分布在三个短周期,它们的原子序数依次增大.其中B与C位于同二周期,A与D、C与F分别位于同一主族,A与D两元索核外电子数之
短周期元素X Y Z的离子具有相同的核外电子排布 离子半径Y大于Z Y与Z可形成常见的离子化合物 原
短周期元素X、Y、Z的离子具有相同的核外电子排布,离子半径Y大于Z,Y与Z可形成常见的离子化合物,原子半径X大于Z,则下列说法中不正确的是( )A.原
无机化合物甲 乙分别由三种元素组成.组成甲 乙化合物的元素原子的特征排布都可表示如下:asa bsb
无机化合物甲、乙分别由三种元素组成.组成甲、乙化合物的元素原子的特征排布都可表示如下:asa、bsbbpb、csccp2c.甲是一种溶解度较小的盐类化合物.由












