A B C D E F六种主族元素分布在三个短周期 它们的原子序数依次增大.其中B与C位于同二周期
| A、B、C、D、E、F六种主族元素分布在三个短周期,它们的原子序数依次增大.其中B与C位于同二周期,A与D、C与F分别位于同一主族,A与D两元索核外电子数之和是C与F两元素原子核内质子数之和的一半,又知六种元索所形成的常见单质在常温常压下有三种是气体,三种是固体.回答下列问题: (1)E的单质不能与盐酸反应,但能与NaOH溶液反应,则E在周期表中的位置是______.E与B形成的化合物硬度很大、不溶于水,且各原子最外层均满足8电子结构,则该化合物的化学式为______,其晶体属于______晶体; (2)C与D能形成化合物D2C2,其电子式为______; (3)氯与F能形成化合物F2Cl2,该化合物与水反应产生大量白雾,溶液变浑浊,生成液能使品红溶液褪色,写出该反应的化学方程式______; (4)化合物B2A4能与C2在稀NaOH溶液中以Pt作电极形成燃料电池,则电池负极的电极反式为______电池工作一段时间后,电解质溶液的PH______ (增大、不变、减小); (5)在容积为10L的恒容密闭容器中,通入2mol FC2气体和3mol C2的气体,一定条件下反应后生成FC3气体.当反应达平衡时,容器中的压强比反应前减少了
|
参考解答
| A、B、C、D、E、F六种主族元素分布在三个短周期,它们的原子序数依次增大.其中B与C位于同二周期,A的原子序数小于B,则A为氢元素;C与F分别位于同一主族,分别处于第二、第三周期,二者原子核内质子数之和的一半为7~13,A与D同主族、A与D两元索核外电子数之和是C与F两元素原子核内质子数之和的一半,则D为钠元素;故C与F的原子序数之和为2(1+11)=24,C与F分别位于同一主族,令C的原子序数为x,则x+x+8=24,解得x=8,故C为氧元素,F为硫元素;六种元索所形成的常见单质在常温常压下有三种是气体,三种是固体,原子序数E介于11~16之间,则E单质为固体,所以B单质为气体,B与C位于同二周期,C为氧元素,B原子序数小于氧元素,则B为氮元素. 故A为氢元素;B为氮元素,C为氧元素,D为钠元素;F为硫元素;原子序数E介于11~16之间. (1)原子序数E介于11~16之间,E的单质不能与盐酸反应,但能与NaOH溶液反应,则E为硅元素,有3个电子层,最外层有4个电子,在周期表中的位置是第三周期第ⅣA族;B为氮元素,E与B形成的化合物硬度很大、不溶于水,且各原子最外层均满足8电子结构,则该化合物的化学式为 Si3N4,其晶体属于原子晶体. 故答案为:第三周期第ⅣA族;Si3N4;原子. (2)C为氧元素,D为钠元素;C与D能形成化合物D2C2是Na2O2,过氧化钠是离子化合物,由钠离子与过氧根离子构成,其电子式为 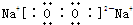 . 故答案为: 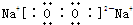 . (3)F为硫元素,氯与F能形成化合物F2Cl2为S2Cl2,该化合物与水反应产生大量白雾,说明生成HCl,溶液变浑浊,有S单质生成,生成液能使品红溶液褪色,说明有二氧化硫生成,该反应的化学方程式为2S2Cl2+2H2O=4HCl+SO2↑+3S↓. 故答案为:2S2Cl2+2H2O=4HCl+SO2↑+3S↓. (4)化合物N2H4能与O2在稀NaOH溶液中以Pt作电极形成燃料电池,负极发生氧化反应,N2H4在负极放电,生成氮气与水,则电池负极的电极反式为N2H4+4OH--4e-=N2+4H2O;正极反应式为O2+2H2O+4e-=4OH-,溶液中氢氧根离子不变,生成水,氢氧根离子浓度减小,电池工作一段时间后,电解质溶液的PH减小. 故答案为:N2H4+4OH--4e-=N2+4H2O;减小. (5)在容积为10L的恒容密闭容器中,通入2mol SO2气体和3molO2的气体,一定条件下反应后生成SO3气体.当反应达平衡时,容器中的压强比反应前减少了
2 SO2+O2=2 SO3 气体物质的量减少△n 2 1 nmol 0.5mol 解得n=1mol.所以1mol二氧化硫反应放出的热量为Q kJ. 该反应的热化学方程式为2 SO2(g)+O2(g)=2SO3(g)△H=-2Q kJ/mol. 故答案为:2 SO2(g)+O2(g)=2SO3(g)△H=-2Q kJ/mol. |
相似问题
短周期元素X Y Z的离子具有相同的核外电子排布 离子半径Y大于Z Y与Z可形成常见的离子化合物 原
短周期元素X、Y、Z的离子具有相同的核外电子排布,离子半径Y大于Z,Y与Z可形成常见的离子化合物,原子半径X大于Z,则下列说法中不正确的是( )A.原
无机化合物甲 乙分别由三种元素组成.组成甲 乙化合物的元素原子的特征排布都可表示如下:asa bsb
无机化合物甲、乙分别由三种元素组成.组成甲、乙化合物的元素原子的特征排布都可表示如下:asa、bsbbpb、csccp2c.甲是一种溶解度较小的盐类化合物.由
几种短周期元素的原子半径及主要化合价见下表:元素代号LMQRT原子半径/nm0.1600.1430.
几种短周期元素的原子半径及主要化合价见下表:元素代号LMQRT原子半径 nm0 1600 1430 1020 0890 074主要化合价+2+3+6、-2+2-2下列叙述正确的是( )A
有A B C D E 5种元素 它们的核电荷数依次增大 且都小于20。其中C E是金属元素;A和E属
有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,
A B均为短周期元素.已知A元素原子的最外层电子数为a 次外层电子数为b;B元素原子的M层电子数为(
A、B均为短周期元素.已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则下列关于A、B形成的化












