已知A B C D E F都是周期表中前四周期的元素.它们的原子序数依次增大.其中A C原子的L层有
| 已知A、B、C、D、E、F都是周期表中前四周期的元素.它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示) (1)写出C原子的价层电子排布图______,F位于周期表______区. (2)A、B、C的第一电离能由小到大的顺序为______.(写元素符号) (3)F和质子数为25的M的部分电离能数据列于下表
(4)晶胞中F原子的配位数为______,若F原子的半径为rcm,则F晶体的密度为______(用含r的表达式表示),该晶胞中原子空间利用率为______. (5)H2S和C元素的氢化物(分子式为H2C2的主要物理性质比较如下
| ||||||||||||||||||||||||||
参考解答
A、C原子的L层有2个未成对电子,电子排布图分别为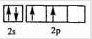 、 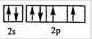 ,原子序数A小于C,则A为C元素,C为O元素,则B为N元素,D的二价阳离子与C的阴离子具有相同的电子层结构,D应为Mg元素,D与E同主族,则E应为Ca元素,F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素,则 (1)C为O元素,原子的价层电子排布图为  ,F为Fe元素,原子核外含有d电子,位于周期表d区, 故答案为:  ;d; (2)同周期元素从左到右元素的第一电离能呈增大趋势,由于N的2p电子为半充满状态性质稳定,则第一电离能大于O,则有C<O<N,故答案为:C<O<N; (3)质子数为25的元素为Mn,Mn2+的3d轨道电子排布为半满状态较稳定,则再失去一个电子比气态Fe2+再失去一个电子难, 故答案为:Mn2+的3d轨道电子排布为半满状态较稳定; (4)Fe为体心立方堆积,配位数为8,空间利用率为68%,该晶胞含有Fe2+个数为8×
Fe原子的半径为rcm,由晶胞结构可知,晶体的体积为(
根据密度=
故答案为:8;
(5)O的电负性较大,形成的氢化物H2O2含有氢键,与水分子可形成氢键,则沸点较高, 故答案为:H2O2分子间存在氢键,与水分子可形成氢键. |
相似问题
甲 乙 丙 丁4种物质分别含2种或3种元素 它们的分子中各含18个电子 甲是气态氢化物 在水中分步电
甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断合理的是( )A.某钠
A B C三种元素的原子具有相同的电子层数 而B的核电荷数比A大2 C原子的电子总数比B原子电子总数
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4,1molA单质跟盐酸反应可置换出11 2L(标准状况下)
用A+ B- C2- D E F G分别表示含有18个电子七种微粒(离子或分子).回答:(1)A元素
用A+、B-、C2-、D、E、F、G分别表示含有18个电子七种微粒(离子或分子).回答:(1)A元素是______、B元素是______.B-的结构示意图为______、C元素是__
五种短周期元素有关数据如表.其中的X是表示元素原子在分子内吸引电子能力的大小 X越大 原子吸引电子的
五种短周期元素有关数据如表.其中的X是表示元素原子在分子内吸引电子能力的大小,X越大,原子吸引电子的能力越强,其最大值为4 0,最小值是0 7.试回答
短周期元素A B C原子序数依次递增 它们的原子的最外层电子数之和为10.A与C在周期表中同主族 B
短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10.A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数.下列叙述正确












