A B C D是四种短周期元素 E F是过渡元素.A B C同周期 C D同主族 A的原子结构示意图
A、B、C、D是四种短周期元素,E、F是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: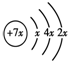 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题: ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:(1)A的基态原子的电子排布式是______; (2)B的最高价氧化物的化学式为______,C的最低负化合价为______. (3)用轨道表示式表示D原子核外电子排布______; (4)解释为什么E的外围电子排布式为3d′54s1,而不为3d44s2?______; (5)F原子结构示意图是______. |
参考解答
A、B、C、D是四种短周期元素,A的原子结构示意图为: ,x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E、F是过渡元素,E、F的外围电子排布式分别为3d54s1,3d64s2,故E为Cr元素,F为Fe元素, ,x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E、F是过渡元素,E、F的外围电子排布式分别为3d54s1,3d64s2,故E为Cr元素,F为Fe元素,(1)A为Si元素,原子核外电子数为14,基态原子的电子排布式是:1s22s22p63s23p2,故答案为:1s22s22p63s23p2; (2)B为Na元素,最高价氧化物的化学式为:Na2O;C为P元素,最外层电子数为5,最低负化合价为-3,故答案为:Na2O;-3; (3)D为N元素,原子核外电子数为7,核外电子轨道表示为: 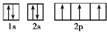 ,故答案为: ,故答案为: ; ;(4)E的外围电子呈3d′54s1时,3d、4s轨道上的电子处于半满状态,整个体系的能量最低,故么E的外围电子排布式为3d′54s1,而不为3d44s2; 故答案为:E的外围电子呈3d′54s1时,3d、4s轨道上的电子处于半满状态,整个体系的能量最低; (5)F为Fe元素,是26号元素,Fe原子结构示意图是: 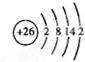 ,故答案为: ,故答案为: . . |
相似问题
某主族元素R原子的质量数为79 已知R离子含有45个中子和36个电子 下列有关R的叙述错误的是(
某主族元素R原子的质量数为79,已知R离子含有45个中子和36个电子,下列有关R的叙述错误的是( )A.R位于第四周期VIA族B.R最高价氧化物对应的水化物
A B C D E是五种常见的短周期主族元素 它们的原子序数依次增大 其中A与C B与D分别同族 已
A、B、C、D、E是五种常见的短周期主族元素,它们的原子序数依次增大,其中A与C、B与D分别同族,已知B、D两种元素原子核中质子数之和是A、C两种元素原子核
已知A B C D E F均为前四周期元素 A元素的原子价电子排布为ns2np2 B元素的最外层电子
已知A,B,C,D,E,F均为前四周期元素,A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍.C元素原子的M电子层的P亚层中有3个未成
A B C D为短周期内除稀有气体外的元素 它们的原子序数依次增大.四种元素中只有C为金属元素;A和
A、B、C、D为短周期内除稀有气体外的元素,它们的原子序数依次增大.四种元素中只有C为金属元素;A和C的最外层电子数相等;B、D属于同主族;C、D两元素原
下列说法正确的是( )A.在元素周期表中 元素所在族的族序数等于原子核外最外层电子数B.在元素周期
下列说法正确的是( )A.在元素周期表中,元素所在族的族序数等于原子核外最外层电子数B.在元素周期表中,元素所在的周期数等于原子核外电子数C.最












