已知下列热化学方程式:(10分)①H2(g)+O2(g)=H2O(l) ΔH=-285.8 kJ·m
| 已知下列热化学方程式:(10分) ①H2(g)+ 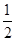 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1②H2(g)+ 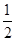 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1③C(s)+ 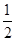 O2(g)=CO(g) ΔH=-110.5 kJ·mol-1 O2(g)=CO(g) ΔH=-110.5 kJ·mol-1④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1, 回答下列问题: (1)上述反应中属于放热反应的是____________。 (2)H2的燃烧热为____________;C的燃烧热为____________。 (3)燃烧10 g H2生成液态水,放出的热量为____________。 (4)写出CO燃烧的热化学方程式__________________________________。 |
参考解答
| (每空2分,共10分) (1)①②③④ (2)285.8 kJ·mol-1 393.5 kJ·mol-1 (3)1429kJ (4)CO(g)+ 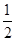 O2(g)=CO2(g) ΔH=-283.5 kJ·mol-1 O2(g)=CO2(g) ΔH=-283.5 kJ·mol-1 |
试题分析:放热反应的ΔH<0故①②③④都属于放热反应;H2的燃烧热反应方程式是①式为285.8 kJ·mol-1;C的燃烧热反应方程式是④式为393.5 kJ·mol-1 ;燃烧10 g H2生成液态水,放出的热量为1429kJ ;CO燃烧的热化学方程式由盖斯定律得④—③即CO(g)+ 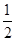 O2(g)=CO2(g) ΔH=-283.5 kJ·mol-1。 O2(g)=CO2(g) ΔH=-283.5 kJ·mol-1。点评:在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。 定义要点: ①规定在101 kPa压强,常温25度下测出热量,因为压强和温度不定,反应热数值不相同. ②规定可燃物物质的量为1 mol. ③规定可燃物完全燃烧生成稳定化合物所放出的热量为标准. 注意点: 燃烧热是以1 mol可燃物作为标准来进行测定的,因此在计算燃烧热时,热化学方程式里其他物质的化学计量数常出现分数:如H2(g)+ 1/2O2(g)====H2O(l);ΔH=-285.8 kJ·mol-1。 点拨 (1)书写燃烧反应的热化学方程式时可燃物一定是1 mol,即可燃物的计量系数一定是1,其他物质的计量系数可以用分数或小数表示(建议用分数)。 (2)单质或化合物必须是完全燃烧,如反应物中C→CO2,H2→H2O(液),S→SO2(气)等。 (3)这里的燃烧概念是广义的,但通常是指可燃物与O2反应的燃烧热。 |
相似问题
(17分)20世纪30年代 Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化
(17分)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的
下列关于离子键的说法中 不正确的是A.离子键就是阴 阳离子间强烈的相互作用B.非金属元素形成的化合物
下列关于离子键的说法中,不正确的是A.离子键就是阴、阳离子间强烈的相互作用B.非金属元素形成的化合物中不可能存在离子键C.离子键不可能存在于单质分
共价键 离子键和分子间作用力是微粒之间的三种作用力。下列晶体 ①Ba(OH)2②SiO2 ③金刚石
共价键、离子键和分子间作用力是微粒之间的三种作用力。下列晶体 ①Ba(OH)2②SiO2 ③金刚石 ④KCl ⑤干冰中,含有两种作用力的是A.①②③B.①⑤C.
下列物质中 只含有极性共价键的是A.NaOHB.NaClC.Cl2D.H2S
下列物质中,只含有极性共价键的是A.NaOHB.NaClC.Cl2D.H2S
下列物质中 含极性键和非极性键且分子有极性的是( )A.乙烯B.H2O2C.甲烷D.三氯甲烷
下列物质中,含极性键和非极性键且分子有极性的是( )A.乙烯B.H2O2C.甲烷D.三氯甲烷












