(17分)20世纪30年代 Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化
| (17分)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题: (1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。在反应体系中加入催化剂,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”),对反应热是否有影响?_______________,原因是_________ 。 (2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题: ① P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式 。 ② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2______△H1(填“大于”、“小于”或“等于”),原因是 。 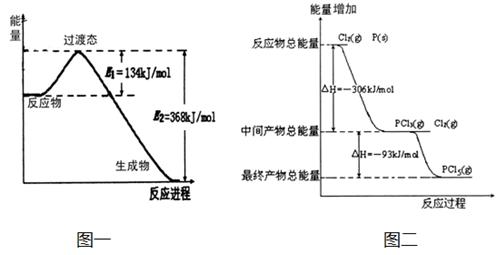 |
参考解答
| (1) NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234 kJ/mol;减小;减小;无影响;催化剂只降低反应的活化能,不能改变反应物的总能量和生成物的总能量之差,即反应热不改变。(或:因为催化剂只降低反应的活化能,同等程度的降低E1、E2的值,则E1—E2的差(即反应热)不改变。) (2)①P(s) +3/2Cl2(g) ='=' PCl3(g) △H=-306 kJ/mol ②等于;根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。 |
| (1)根据图像可知反应物的总能量高于生成物的总能量,所以是放热反应,放出的热量是368kJ-134kJ=234kJ。因此热化学方程式为 NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234 kJ/mol。催化剂能降低反应的活化能,从而加快反应速率。但不会影响反应热的大小,所以E1和E2都是减小的。 (2)①根据图像可判断,生成1molPCl3时放出306kJ热量,所以热化学方程式为P(s) +3/2Cl2(g) ='=' PCl3(g) △H=-306 kJ/mol。 ②根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,所以反应热是相等的。 |
相似问题
下列关于离子键的说法中 不正确的是A.离子键就是阴 阳离子间强烈的相互作用B.非金属元素形成的化合物
下列关于离子键的说法中,不正确的是A.离子键就是阴、阳离子间强烈的相互作用B.非金属元素形成的化合物中不可能存在离子键C.离子键不可能存在于单质分
共价键 离子键和分子间作用力是微粒之间的三种作用力。下列晶体 ①Ba(OH)2②SiO2 ③金刚石
共价键、离子键和分子间作用力是微粒之间的三种作用力。下列晶体 ①Ba(OH)2②SiO2 ③金刚石 ④KCl ⑤干冰中,含有两种作用力的是A.①②③B.①⑤C.
下列物质中 只含有极性共价键的是A.NaOHB.NaClC.Cl2D.H2S
下列物质中,只含有极性共价键的是A.NaOHB.NaClC.Cl2D.H2S
下列物质中 含极性键和非极性键且分子有极性的是( )A.乙烯B.H2O2C.甲烷D.三氯甲烷
下列物质中,含极性键和非极性键且分子有极性的是( )A.乙烯B.H2O2C.甲烷D.三氯甲烷
下列物质中既含离子键 又含共价键的是 ( )A.NaClB.MgCl2C.H2O2D.NaOH
下列物质中既含离子键,又含共价键的是()A.NaClB.MgCl2C.H2O2D.NaOH












