A B C D E为短周期元素 其原子序数依次增大.其中 A元素原子半径最小;B元素原子的电子总数与
| A、B、C、D、E为短周期元素,其原子序数依次增大.其中,A元素原子半径最小;B元素原子的电子总数与最外层电子数之比为3:2;C元素最高价氧化物对应水化物与其氢化物反应生成一种盐甲.A、E同主族,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.请回答: (1)写出B元素在周期表中的位置______,C单质的电子式是______. (2)A、D、E组成的化合物乙与氯化亚铁溶液反应的实验现象为______. (3)常温下,甲的水溶液pH______7(填>、<或=),其原因是(用离子方程式表示)______. (4)乙和B、D、E组成的化合物丙,它们的水溶液pH均为12时,两溶液中由水电离出的c(OH-),乙:丙=______. (5)A和B组成化合物丁,其相对分子质量为16.将如图装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成等现象.油状液滴的成分可能是(写分子式)______.  |
参考解答
| A、B、C、D、E为短周期元素,其原子序数依次增大.B元素原子的电子总数与最外层电子数之比为3:2,则B为碳元素;A元素原子半径最小,原子序数小于6,则A为氢元素;C元素最高价氧化物对应水化物与其氢化物反应生成一种盐甲,则C为氮元素,甲为硝酸铵;A、E同主族,E的原子序数大于6,则E为钠元素;A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,则D为氧元素. 故A为氢元素;B为碳元素;C为氮元素,D为氧元素,E为钠元素;甲为硝酸铵. (1)B为碳元素,有2个电子层,最外层电子数为4,处于周期表第二周期第ⅣA族.C为氮元素,单质为氮气,分子中氮原子之间形成3对共用电子对,电子式为 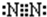 故答案为:第二周期第ⅣA族; 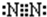 . (2)A、D、E组成的化合物乙为NaOH,与氯化亚铁溶液反应的实验现象为生成白色絮状沉淀迅速变成灰绿色,最后变成红褐色. 故答案为:生成白色絮状沉淀迅速变成灰绿色,最后变成红褐色. (3)甲为硝酸铵,是强酸弱碱盐,常温下,铵根离子水解NH4++H2O  NH3?H2O+H+,溶液呈酸性,即甲的水溶液pH<7. 故答案为:<;NH4++H2O  NH3?H2O+H+. (4)乙为NaOH,B、D、E组成的化合物丙为碳酸钠,它们的水溶液pH均为12时,氢氧化钠溶液中氢离子浓度等于水电离的氢氧根离子浓度为10-12mol/L,碳酸钠溶液中氢氧根离子的浓度为水电离的氢氧根浓度为10-2mol/L,所以溶液中由水电离出的c(OH-),乙:丙=10-12mol/L:10-2mol/L=10-10:1. 故答案为:10-10:1. (5)A和B组成化合物丁,其相对分子质量为16,则丁为CH4,将如图装置放置在光亮的地方(日光没有直接照射), 氯气与甲烷发生取代反应,观察到量筒壁上有油状液滴生成等现象,油状液滴的成分可能是CH2Cl2、CHCl3、CCl4.故答案为:CH2Cl2、CHCl3、CCl4. |
相似问题
(多选题)X Y Z为三种不同的短周期元素 X Y处在相邻的两个周期 X原子的最外层电子数是Y原子最
(多选题)X、Y、Z为三种不同的短周期元素,X、Y处在相邻的两个周期,X原子的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原
现有A B C D E五种短周期元素 已知他们的原子序数依次增大 元素A的原子只有一个电子层;又知元
现有A、B、C、D、E五种短周期元素,已知他们的原子序数依次增大,元素A的原子只有一个电子层;又知元素A能分别与元素B、C、D形成电子总数相等的化合物分
在原子序数1-18号元素中 按要求用合适的化学用语填空:(1)与水反应最剧烈的金属是______.(
在原子序数1-18号元素中,按要求用合适的化学用语填空:(1)与水反应最剧烈的金属是______.(2)与水反应最剧烈的非金属单质是______.(3)原子半径最
已知A B C D E F G H是原子序数依次增大的八种元素 A元素是周期表中原子半径最小的元素
已知A、B、C、D、E、F、G、H是原子序数依次增大的八种元素,A元素是周期表中原子半径最小的元素,B、C和D同周期,E、F和G同周期,A、E同主族,D、G、H同
原子序数为13的元素位于元素周期表中第______周期 ______族 其原子结构示意图为_____
原子序数为13的元素位于元素周期表中第______周期、______族,其原子结构示意图为______.












