为证明化学反应有一定的限度 进行如下探究活动:I.取5 mL 0.1 mol/L的KI溶液 滴加5~
| 为证明化学反应有一定的限度,进行如下探究活动: I.取5 mL 0.1 mol/L的KI溶液,滴加5~6滴稀FeCl3溶液; Ⅱ.继续加入2 mL CCl4溶液,振荡; Ⅲ.取萃取后的上层清液,滴加KSCN溶液。 (1)探究活动I的实验现象为_______________ 探究活动Ⅱ的实验现象为________________ (2)探究活动Ⅲ的目的是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想: 猜想一:Fe3+全部转化为Fe2+; 猜想二:生成的Fe(SCN)3溶液浓度极小,无法用肉眼观察其颜色。为了验证猜想,查阅资料获得下列信息: 信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中的大; 信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN高。 结合新信息,现设计以下实验方案验证猜想: ①请完成下表: |
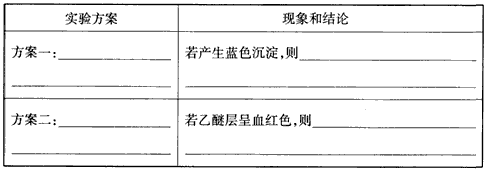 |
| ②写出实验操作“方案一”中反应的离子方程式:_______________。 Ⅳ.为了测定探究活动I中的稀FeCl3溶液的浓度,现进行以下操作: (3)移取25.00 mL稀FeCl3溶液至锥形瓶中,加入__________作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点时的现象是____________________。 (4)重复滴定三次,平均耗用c mol/L KI标准溶液V mL,则稀FeCl3溶液中溶质的物质的量浓度为_______ mol/L。 |
参考解答
| (1)液体呈棕褐色;溶液分层,下层四氯化碳层呈紫色 |
(2)①  |
| ②4Fe3++3[Fe(CN)64-=Fe4[Fe(CN)63↓ (3)KSCN溶液;当滴加最后一滴KI标准溶液时,红色褪去且半分钟内不恢复 (4)0.04cV |
相似问题
铁在冷的浓硫酸中会发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时 铁完全溶解 并产生大量气
铁在冷的浓硫酸中会发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol·L-1的酸
已知某白色混合物粉末中含有CuSO4 K2SO4 NH4HCO3 NH4Cl NaCl五种物质中的两
已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种。请完成下述探究此混合物组成的实验。仅限选择的仪器、用品和试剂:烧
某校研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是Cu2O提出质疑。 (1
某校研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是Cu2O提出质疑。 (1)甲小组认为红色沉淀不一定是Cu2O,为此展开了确定红
证明“光合作用需要CO2的实验”可利用下图中的甲(玻璃缸中盛有NaOH溶液) 乙(玻璃缸中盛有清水)
证明“光合作用需要CO2的实验”可利用下图中的甲(玻璃缸中盛有NaOH溶液)、乙(玻璃缸中盛有清水)两个装置,将这两个装置同时放在黑暗处一昼夜,然后一
实验室有一瓶久置的Na2SO3固体 其是否变质?变质的程度如何?为了解决这些问题 同学们进行了如 下
实验室有一瓶久置的Na2SO3固体,其是否变质?变质的程度如何?为了解决这些问题,同学们进行了如 下探究:可选用试剂:浓H2SO4、浓HNO3、10%盐酸、0 1mo












