(10 分)氧化镁在医药 建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(
(10 分)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下: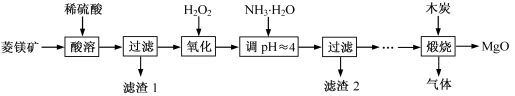 (1)MgCO3与稀硫酸反应的离子方程式为 。 (2)加入H2O2氧化时,发生反应的化学方程式为 。 (3)滤渣2 的成分是 (填化学式)。 (4)煅烧过程存在以下反应: 2MgSO4+C 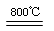 2MgO+2SO2↑+CO2↑ 2MgO+2SO2↑+CO2↑MgSO4+C  MgO+SO2↑+CO↑ MgO+SO2↑+CO↑MgSO4+3C  MgO+S↑+3CO↑ MgO+S↑+3CO↑利用下图装置对煅烧产生的气体进行分步吸收或收集。 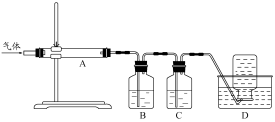 ①D中收集的气体可以是 (填化学式)。 ②B中盛放的溶液可以是 (填字母)。 a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液 ③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。 |
参考解答
| (1)MgCO3+2H+=Mg2++CO2↑+H2O (2分) (2)2FeSO4+H2O2+H2SO4= Fe2(SO4)3+2H2O (2分) (3)Fe(OH)3 (2分) (4)①CO (1分) ②d (1分) ③3S+6OH-  2S2-+SO32-+3H2O (2分) 2S2-+SO32-+3H2O (2分) |
试题分析:解化学工艺流程题要注意①审题头,明确化工生产的原料和目的,②审流程,结合题给信息明确每一步的目的和原理,③答题要注意规范书写化学用语和文字表达;本题是以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁,经过硫酸酸溶得硫酸镁、硫酸亚铁溶液和不溶物,过滤为除去不溶物,用过氧化氢氧化,将二价铁氧化为三价铁,用氨水调pH,将三价铁离子转化氢氧化铁沉淀而除去,最后得硫酸镁溶液,经后续操作的氧化镁;(1)MgCO3与稀硫酸反应生成硫酸镁、水和二氧化碳,离子方程式为MgCO3+2H+=Mg2++CO2↑+H2O;(2)加入H2O2氧化时,硫酸亚铁被氧化为硫酸铁,发生反应的化学方程式为2FeSO4+H2O2+H2SO4= Fe2(SO4)3+2H2O;(3)滤渣2 的成分是Fe(OH)3;(4)分析题给反应知,气体的成分为SO2、CO2和CO,SO2具有还原性,可利用KMnO4溶液吸收,用氢氧化钠溶液吸收二氧化碳,最后用排水法收集CO;A中得到的淡黄色固体S与热的NaOH溶液反应反应的离子方程式为:3S+6OH-  2S2-+SO32-+3H2O;答案为:①CO ②d ③3S+6OH- 2S2-+SO32-+3H2O;答案为:①CO ②d ③3S+6OH- 2S2-+SO32-+3H2O。 2S2-+SO32-+3H2O。 |
相似问题
实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )A.装置③可用于收集H2 CO2
实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )A.装置③可用于收集H2、CO2、Cl2、NH3等气体B.装置②可用于吸收NH3或HCl气体,并防止倒吸
为探究某抗酸药X的组成 进行如下实验:查阅资料:①抗酸药X可能的组成可以表示为:MgmAln(OH)
为探究某抗酸药X的组成,进行如下实验:查阅资料:①抗酸药X可能的组成可以表示为:MgmAln(OH)p(CO3)q(SiO3)r(m、n、p、q、r为≥0的整数)。②在pH=5 0
除去下列物质中的少量杂质(括号内的物质为杂质) 加入试剂或方法不正确的是 A.NaCl溶液(BaCl
除去下列物质中的少量杂质(括号内的物质为杂质),加入试剂或方法不正确的是 A.NaCl溶液(BaCl2):加入足量Na2CO3溶液,过滤,再向滤液中加适量盐酸
除去括号内的杂质 写出所加试剂的化学式(1)Cl-(SO42-): (2)SO42-(CO
除去括号内的杂质,写出所加试剂的化学式(1)Cl-(SO42-):(2)SO42-(CO32-):(3)Fe2+(Cu2+):
【材料一】苏教版《化学1(必修)》工业上从海产品(海带)中获取碘的流程图如下:(1)上述生产流程的第
【材料一】苏教版《化学1(必修)》工业上从海产品(海带)中获取碘的流程图如下:(1)上述生产流程的第一步是“浸泡”,它的实验目的是;(2)“氧化”












