(10分)实验室有三瓶失去标签的无色溶液:氯化钾 氢氧化钙和稀硫酸 可用一种常见酸碱指示剂X 或Na
(10分)实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种常见酸碱指示剂X 或Na2CO3一次鉴别它们。根据有关操作及所加试剂填空。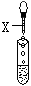 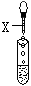 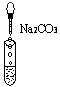 A B C (1)A试管中的现象:溶液显紫色;另取该溶液滴入Na2CO3溶液中,无明显现象。 试推断试剂X为 。 (2)B试管中的现象:溶液显蓝色;另取该溶液滴入Na2CO3溶液中的现象为 ___ 有关反应的离子方程式为 __________。 (3)C试管中的现象:有气泡产生,有关反应的离子方程式为 _________; 另取该溶液滴入试剂X, 则溶液显 _____________。 |
参考解答
| (每空2分,共10分)(1)紫色石蕊试液 (2)有白色沉淀产生;CO32-+Ca2+=CaCO3↓ (3)CO32-+2H+=H2O+CO2↑;红色 |
试题分析:(1)氯化钾是盐,溶液显中性,氢氧化钙是强碱,硫酸是强酸。根据酸碱指示剂的变色可知,A中溶液显紫色,这说明X一定是紫色的石蕊试液,因此A中的溶液一定不是硫酸。又因为另取该溶液滴入Na2CO3溶液中,无明显现象,所以该溶液是氯化钾。 (2)碱能使紫色的石蕊试液显蓝色,所以B中溶质是氢氧化钙,则滴入Na2CO3溶液中的现象为有白色沉淀生成,反应的离子方程式是CO32-+Ca2+=CaCO3↓。 (3)C中是硫酸。硫酸和碳酸钠反应生成CO2气体,反应的离子方程式CO32-+2H+=H2O+CO2↑;酸能使紫色的石蕊试液显红色。 点评:该题是高考中的常见题型,试题基础性强,难易适中。该题的突破点是溶液显紫色,然后再依据有关物质的化学性质,逐一分析、排除即可得出正确的结论。该题有利于培养稀释的逻辑思维能力和发散思维能力。 |
相似问题
实验题:(14分)某学生为了验证氢气还原氧化铜的产物 设计了下图所示的实验装置。⑴ 写出编号仪器的名
实验题:(14分)某学生为了验证氢气还原氧化铜的产物,设计了下图所示的实验装置。⑴ 写出编号仪器的名称: ①______________⑵ 写出A中反应的离子方
区分硬水和软水的最佳方法是A.观察是否澄清 透明。澄清透明的为软水 不澄清透明的为硬水B.品尝是否有
区分硬水和软水的最佳方法是A.观察是否澄清、透明。澄清透明的为软水,不澄清透明的为硬水B.品尝是否有异味。无异味的为软水,有异味的为硬水C.用肥皂
为了检验久置的FeSO4溶液是否变质 最好向适量样品中加入A.KSCN溶液B.稀硫酸C.氨水D.铁
为了检验久置的FeSO4溶液是否变质,最好向适量样品中加入A.KSCN溶液B.稀硫酸C.氨水D.铁
用图所示装置检验乙烯时不需要除杂的是 乙烯的制备试剂X试剂YACH3CH2Br与NaOH乙醇溶液共热
用图所示装置检验乙烯时不需要除杂的是乙烯的制备试剂X试剂YACH3CH2Br与NaOH乙醇溶液共热H2OKMnO4酸性溶液BCH3CH2Br与NaOH乙醇溶液共热H2OBr2的CCl4溶液C
某同学为了验证海带中含有碘 拟进行如下实验 请回答相关问题。(1)第1步:灼烧。操作是将足量海带灼烧
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有












