(14分)为了除去KCl溶液中少量的MgCl2 MgSO4 可选用Ba(OH)2 HCl和K2CO3
(14分)为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作: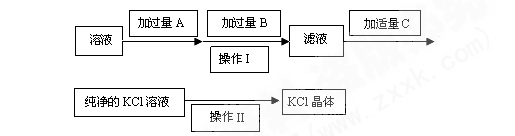 (1)写出上述试剂的化学式:A , B 。 (2) 上述操作Ⅰ所用玻璃仪器的名称是 ; 操作Ⅱ的名称是 。 (3) 加过量A时发生有关反应的离子反应方程式为: 、 。 (4)检验B是否过量的方法是 |
参考解答
| (14分)(1)A Ba(OH)2 B K2CO3 (2) 漏斗、玻璃棒、烧杯; 蒸发 (3) Mg2+ +2OH― =Mg(OH)2 ↓ 、 Mg2+ +SO42― +Ba2+ +2OH― =Mg(OH)2 ↓+BaSO4↓ 。 (4)取滤液少许,加入稀盐酸,产生气泡现象,说明K2CO3过量 |
试题分析:氯化镁和硫酸镁都可以用氢氧化钡除去,而过量的氢氧化钡可以利用碳酸钾除去,因此A是氢氧化钡,B是碳酸钾,过滤后用盐酸进行酸化,所以C是氯化钾。而从氯化钾溶液中得到氯化钾晶体时应该通过蒸发结晶的方法。 点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1. 不能引入新的杂质(水除外)。即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中。 2. 分离提纯后的物质状态不变。 3. 实验过程和操作方法简单易行。即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。 分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下: 1. 分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解) ,溶解,过滤(洗涤沉淀) ,蒸发,结晶(重结晶) ,电精炼。 2. 分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏。 3. 分离提纯物是胶体:盐析或渗析。 4. 分离提纯物是气体:洗气。 |
相似问题
有人从市场上购得一瓶“纯净水” 喝过之后感觉有点苦涩味 怀疑是由深层地下水冒充的伪劣产品。已知地下水
有人从市场上购得一瓶“纯净水”,喝过之后感觉有点苦涩味,怀疑是由深层地下水冒充的伪劣产品。已知地下水含Ca2+、Mg2+等离子,家庭中的下列物品可用于
选择一种溶剂将碘水中的碘萃取出来 这种溶剂应具备的性质是A.不溶于水 且密度必须比水大B.不溶于水
选择一种溶剂将碘水中的碘萃取出来,这种溶剂应具备的性质是A.不溶于水,且密度必须比水大B.不溶于水,且密度必须比水小C.不溶于水,且比水更容易使碘
下列各组混合物中 能用分液漏斗进行分离的是( )A.水和酒精B.水和植物油C.水和醋酸D.水和蔗
下列各组混合物中,能用分液漏斗进行分离的是( )A.水和酒精B.水和植物油C.水和醋酸D.水和蔗糖
有一已磨成粉末的混合物试样 是由下列六种物质中的若干种等量组成﹕(A) NaCl (B) KCl
有一已磨成粉末的混合物试样,是由下列六种物质中的若干种等量组成﹕(A) NaCl (B) KCl (C) CaCl2 (D) CuSO4( 无水) (E) Na2SO4 (F)
(每空3分共计10分)硫酸工业中废渣称为硫酸渣 其成分为SiO2 Fe2O3 Al2O3 MgO。某
(每空3分共计10分)硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验












