(每空3分共计10分)硫酸工业中废渣称为硫酸渣 其成分为SiO2 Fe2O3 Al2O3 MgO。某
(每空3分共计10分)硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。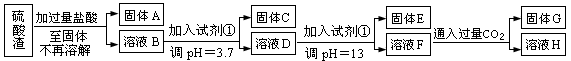 已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答: (1)写出A与氢氧化钠溶液反应的化学方程式: 。 (2)上述流程中两次使用试剂①,推测试剂①应该是 (填以下字母编号)
(4)H中溶质的化学式: ; (5)计算溶液F中c(Mg2+)= (25℃时,氢氧化镁的Ksp=5.6×10-12) |
参考解答
| (1)SiO2+2NaOH=Na2SiO3+H2O (2)A (3)镁离子沉淀不完全或氢氧化铝溶解不完全等 (4)NaHCO3 (5)5.6× 10–10 mol/L |
| (1)硫酸渣中只有二氧化硅和盐酸不反应,所以A是二氧化硅,和氢氧化钠溶液反应的方程式是SiO2+2NaOH=Na2SiO3+H2O。 (2)试剂①的作用是中和溶液中的氢离子,生成氢氧化物沉淀。由于氨水中pH最大只能是11,所以应该选择氢氧化钠,答案选A。 (3)根据流程图可知,固体C是氢氧化铁,E是氢氧化镁,所以如果氢氧化钠不足,则镁离子沉淀不完全,且氢氧化铝溶解也不完全。 (4)溶液F是氢氧化钠和偏铝酸钠的混合物,所以通入足量的CO2是生成沉淀氢氧化铝,而溶液中的溶质则是碳酸氢钠。 (5)溶液中OH-浓度是0.1mol/L,所以根据溶度积常数可知,溶液中c(Mg2+)=5.6×10-12÷0.12=5.6× 10–10 mol/L。 |
相似问题
如果家里的食用油混有水份 你将采用下列何种方法分离( )A.过滤B.蒸馏C.分液D.萃取
如果家里的食用油混有水份,你将采用下列何种方法分离()A.过滤B.蒸馏C.分液D.萃取
有一固体粉末 可能含有Na2CO3 NaCl Na2SO4 CuCl2 Ba(NO3)2 K2CO3
有一固体粉末,可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。⑴将该粉末溶于水得无色溶液和白色
分离下列混合物 按溶解 过滤 蒸发顺序进行的是( )A.氧化铜 木炭B.碳酸钙 氯化钠C.硝酸
分离下列混合物,按溶解、过滤、蒸发顺序进行的是()A.氧化铜、木炭B.碳酸钙、氯化钠C.硝酸钾、氯化钠D.乙醇、水
(4分)为了检验和除去下表中的各种杂质(括号里的物质) 请从(I)中选出适当的检验试剂 从(II)中
(4分)为了检验和除去下表中的各种杂质(括号里的物质),请从(I)中选出适当的检验试剂,从(II)中选出适当的除杂试剂,将所选的答案的括号填入相应
甲 乙 丙 丁分别是Al2(SO4)3 FeSO4 NaOH BaCl2四种物质中的一种 若将丁溶液
甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,片刻沉淀由白色变为灰绿色又变为红












