18.4 g NaOH 和 NaHCO3固体混合物 在密闭容器中加热到约 250℃ 经充分反应后排出
| 18.4 g NaOH 和 NaHCO3固体混合物,在密闭容器中加热到约 250℃,经充分反应后排出气体,冷却,称得剩余固体质量为 16.6 g。试计算原混合物中 NaOH 的质量分数。 |
参考解答
| 54.3% |
发生的反应有:①2NaHCO3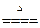 Na2CO3+H2O+CO2↑, Na2CO3+H2O+CO2↑,②2NaOH+CO2 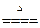 Na2CO3+H2O(加热条件下,不生成 NaHCO3) Na2CO3+H2O(加热条件下,不生成 NaHCO3)通过极限思维可知,原固体混合物中,NaHCO3含量越大,固体失重越大,NaOH 含量越大,固体失重越小。 判断 NaHCO3受热分解产生的 CO2能否被 NaOH 完全吸收是解决问题的关键,这首先需要写出 NaHCO3与 NaOH 恰好完全反应的化学方程式。 题设条件下,固体失重:18.4 g-16.6 g =' 1.8' g。 设固体失重 1.8 g 需恰好完全反应的 NaHCO3和 NaOH 混合物质量为 x,则: 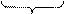 NaHCO3+NaOH NaHCO3+NaOH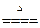 Na2CO3+H2O Na2CO3+H2O124 g 18 g x 1.8 g x = 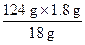 =' 12.4' g<18.4 g =' 12.4' g<18.4 g可见,题设条件下反应发生后 NaOH 过量,过量 NaOH 质量为: 18.4 g-12.4 g =' 6.0' g, 参加反应的 NaOH 质量为: 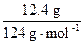 ×40.0 g·mol-1 =' 4.00' g, ×40.0 g·mol-1 =' 4.00' g,原混合物中 NaOH 质量为:6.0 g+4.00 g =' 10.0' g, w(NaOH) = 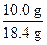 ×100% = 54.3%。 ×100% = 54.3%。答案:54.3% 。 |
相似问题
实验室有甲 乙两瓶无色溶液 其中一瓶是稀盐酸 另一瓶是碳酸钠溶液。为测定甲 乙两瓶溶液的成分及物质的
实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:①量取25 00 mL甲溶液
下图表示A~E五种物质间的相互转化关系 其中A为淡黄色固体 B为单质。试推出各物质的化学式 并写出B
下图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。试推出各物质的化学式,并写出B→C、C→D、D→E反应的化学方程式。
下列有关焰色反应的实验操作注意事项的说明 其中正确的是( )①钾的焰色要透过蓝色钴玻璃观察②先将铂
下列有关焰色反应的实验操作注意事项的说明,其中正确的是( )①钾的焰色要透过蓝色钴玻璃观察②先将铂丝灼烧到与原火焰颜色相同,再蘸取被检物质③每次
下列有关钠的物理性质叙述正确的是( )①银白色金属;②质软 可以用小刀切割;③熔点低于100 ℃;
下列有关钠的物理性质叙述正确的是()①银白色金属;②质软,可以用小刀切割;③熔点低于100 ℃;④密度比水小;⑤热和电的良导体A.①②④B.①②③④
超氧化钾(KO2)常用于急救器中 它能吸收CO2生成K2CO3和O2。若用一定量金属钾在一定条件下与
超氧化钾(KO2)常用于急救器中,它能吸收CO2生成K2CO3和O2。若用一定量金属钾在一定条件下与O2充分反应生成KO2,再用此吸收CO2,则生成KO












