实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因.【分析与猜想】(1)根据过氧化
| 实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因. 【分析与猜想】 (1)根据过氧化钠与水反应的原理:2Na2O2+2H2O═4NaOH+O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会退色,而实验中发现酚酞变红后又退色.由此提出如下的猜想: A.氧气有漂白性 B.氢氧化钠有漂白性 C.______ 【实验与判断】 请完成表格:
(3)可用如图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是______(填选项,下同),②处装入的物质是______. A.酚酞试剂 B.过氧化钠与水反应后的溶液 C.二氧化锰 D.氢氧化钠固体配制的溶液 (4)气体③是______,过氧化钠与水反应的化学方程式没有写出X来,原因是______. 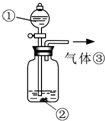 | ||||||||||||||||||||
参考解答
| (1)过氧化钠与水的反应方程式中只有氢氧化钠和氧气生成,所以褪色原因的猜想只能由三种情况:氧气具有漂白性、氢氧化钠具有漂白性、氧气和氢氧化钠共同作用具有漂白性;实验1中,将酚酞加入氢氧化钠溶液中,目的是证明褪色原因是否原因氢氧化钠引起的,所以对应的猜想为B;实验3通入氧气,目的是证明氧气能够使溶液褪色;为了增强说服力,避免干扰,实验1、2中氢氧化钠溶液必须是用氢氧化钠固体配制的, 故答案为:氧气和氢氧化钠共同作用具有漂白性;B;A;氢氧化钠固体; (2)过氧化钠与水反应过程中,钠元素形成了稳定的化合物,其它元素组合形成的不很稳定、具有漂白性的物质X,X只能为具有强氧化性的H2O2, 故答案为:H2O2; (3)双氧水在催化剂二氧化锰作用下能够分解放出氧气,图中装置目的是探究双氧水的不稳定性,所以在①处装入的物质为过氧化钠与水反应后的混合液,②处装入的物质为催化剂二氧化锰, 故答案为:B;C; (4)装置中气体③为双氧水分解生成的氧气;由于过氧化钠与水的反应中,生成的双氧水不稳定,已经分解生成氧气,所以没有写出双氧水分子, 故答案为:O2;H2O2不稳定,已分解. |
相似问题
下面是有关Na及Na2O2性质的探究实验:
下面是有关Na及Na2O2性质的探究实验:
一定温度下 W g下列物质在足量氧气中充分燃烧 产物与过量的过氧化钠完全反应 过氧化钠固体增重W g
一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是[ ]①H2;②CO;③CO和H2;④C2H4O2
金属钠与金属钾的金属性相近 且钾比钠略强。当利用金属钾与钠盐共熔制金属钠时 钾与钠的共熔体难以分离。
金属钠与金属钾的金属性相近,且钾比钠略强。当利用金属钾与钠盐共熔制金属钠时,钾与钠的共熔体难以分离。反之,如调整到一定温度,可用金属钠与氯化钾
关于铷的结构和性质的判断 正确的是( )①与水反应没有钠剧烈 ②它的原子半径比钠小 ③它的氧化物
关于铷的结构和性质的判断,正确的是()①与水反应没有钠剧烈②它的原子半径比钠小③它的氧化物暴露在空气中易吸收二氧化碳④它是还原剂A.①②B.③④C
在120 ℃时 将12.4 g CO2和H2O(g)的混合气体缓缓通过过量的过氧化钠固体 充分反应之
在120 ℃时,将12 4 g CO2和H2O(g)的混合气体缓缓通过过量的过氧化钠固体,充分反应之后,固体的质量增加6 g。请计算:(1)产生氧气的质量。(2)