纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:(
| 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题: (1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:___________________________。 (2)写出“联合制碱法”有关反应的化学方程式:_______________________ (3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_______________________。 (4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计算原子利用率的表达式:原子利用率(%)=_________________。 |
参考解答
(1)2NH4Cl+Ca(OH)2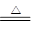 2NH3↑+CaCl2+2H2O 2NH3↑+CaCl2+2H2O(2)NH3+CO2+H2O=NH4HCO3 NaCl+NH4HCO3=NaHCO3↓+NH4Cl 2NaHCO3 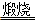 Na2CO3+H2O↑+CO2↑ Na2CO3+H2O↑+CO2↑(3)“联合制碱法”中的CO2来源于合成氨厂,“氨碱法”中的CO2来源于煅烧石灰石 (4) 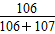 ×100%=49.77% ×100%=49.77% |
| 氨碱法的原料:氯化钠、碳酸钙(或二氧化碳)及氨。 工艺流程:CaCO3 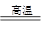 CaO+CO2↑CO2+NH3+H2O=NH4HCO3, CaO+CO2↑CO2+NH3+H2O=NH4HCO3,NaCl+NH4HCO3=NaHCO3↓+NH4Cl,2NaHCO3 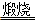 Na2CO3+H2O↑+CO2↑, Na2CO3+H2O↑+CO2↑,CaO+H2O=Ca(OH)2, 产生CaCl2的反应:Ca(OH)2+2NH4Cl 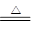 CaCl2+2NH3↑+2H2O,该反应的CaCl2中的Cl-来源于NaCl,Ca2+来源于CaCO3,产生无用的CaCl2,降低了NaCl的利用率。 CaCl2+2NH3↑+2H2O,该反应的CaCl2中的Cl-来源于NaCl,Ca2+来源于CaCO3,产生无用的CaCl2,降低了NaCl的利用率。联合制碱法:NH3和CO2来源于合成氨厂 工艺流程:NH3+CO2+H2O=NH4HCO3, NaCl+NH4HCO3=NaHCO3↓+NH4Cl, 2NaHCO3 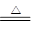 Na2CO3+H2O↑+CO2↑。 Na2CO3+H2O↑+CO2↑。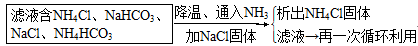 依据总反应:2NaCl+CO2+H2O+2NH3=Na2CO3+2NH4Cl 可得:原子利用率= 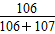 ×100%=49.77%。 ×100%=49.77%。 |
相似问题
分在干燥管A中的块状白色固体为某种正盐 B中为淡黄色粉末 C中为白色粉末 并将A B C按图所示连接
分在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接。打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色
用 类推的方法可能会得出错误结论 因此推出的结论要经过实践的检验才能确定其正确与否。下列推论中正确的
用类推的方法可能会得出错误结论,因此推出的结论要经过实践的检验才能确定其正确与否。下列推论中正确的是[ ]A Na失火不能用CO2灭火,K失火也不能用CO2灭
钠原子与钠离子比较 相同的是 [ ]A.核外电子层数 B.最外
钠原子与钠离子比较,相同的是 [ ]A.核外电子层数B.最外层电子数 C.能与水反应并放出H2D.焰色反应
在隔绝空气的条件下 某同学将一块部分被氧化的钠块用一张已除氧化膜 并用针刺一些小孔的铝箔包好 然后放
在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜,并用针刺一些小孔的铝箔包好,然后放人盛水且倒置于水槽中的容器内。待钠块反应完
纯碱(化学式为Na2CO3)是一种重要的化工原料。现代化工生产有三种工艺:一 布兰制碱法。以食盐为原
纯碱(化学式为Na2CO3)是一种重要的化工原料。现代化工生产有三种工艺:一、布兰制碱法。以食盐为原料制碱,该法分三步:①用氯化钠与硫酸反应制硫酸钠












