纯碱(化学式为Na2CO3)是一种重要的化工原料。现代化工生产有三种工艺:一 布兰制碱法。以食盐为原
| 纯碱(化学式为Na2CO3)是一种重要的化工原料。现代化工生产有三种工艺: 一、布兰制碱法。以食盐为原料制碱,该法分三步: ①用氯化钠与硫酸反应制硫酸钠:2NaCl+H2SO4=Na2SO4+2HCl; ②用焦炭还原硫酸钠得硫化钠:Na2SO4+4C=Na2S+4CO↑ ③用硫化钠与石灰石反应制碳酸钠:Na2S+CaCO3=Na2CO3+CaS 二、氨碱法即索尔维制碱法。以食盐、氨、二氧化碳为原料,其反应也分三步进行: ①NH3+CO2+H2O=NH4HCO3 ②NH4HCO3+NaCl=NaHCO3+NH4Cl ③2NaHCO3=Na2CO3+CO2↑+H2O 三、候氏制碱法。低温下先向饱和食盐水中通入氨气,再通入二氧化碳可析出碳酸氢钠,再加入细盐末,因同离子效应,低温氯化铵溶解度突然降低,而食盐的溶解度变化不大,所以氯化铵析出而食盐不析出;再用氨饱和后通二氧化碳,结果往返析出NaHCO3和NH4Cl。该法生产的纯碱质量优良,纯白如雪。 (1)通过三种方法的比较,布兰制碱法工艺的缺点有 (写两点)。 (2)氨碱法工艺的中循环利用的物质是 (填化学式);产品的副产物NH4Cl既可以做氮肥又可以重新生成氨气。写出NH4Cl与生石灰反应的化学方程式 。 (3)候氏制碱法反应的方程式为 。 (4)为什么候氏制碱法工艺中先向饱和食盐水中通入氨气,再通入二氧化碳。理由是 (写两点)。 (5)候氏制碱法产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,用m1表示加热前纯碱样品的质量,m2表示加热后固体的质量。则纯碱中碳酸氢钠的质量分数可表示为: 。 |
参考解答
| (1)生产时需要高温;硫酸对设备腐蚀严重;CaS废弃物长期堆积臭气四溢;成本较高。(4分,答出以上任意两点各2分,其他合理答案均给分) (2)CO2(1分) 2NH4Cl+CaO  2NH3↑+CaCl2+H2O(2分) 2NH3↑+CaCl2+H2O(2分)(3)NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl(2分) (4)CO2在水中的溶解度较小,吸收率低;后通入CO2保证全部生成NaHCO3(4分,答出以上任意两点各2分,其他合理答案均给分) (5) 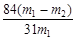 (2分) (2分) |
试题分析:(1)布兰制碱法工艺的缺点有焦炭还原硫酸钠时需要高温;硫酸对设备腐蚀严重;CaS废弃物长期堆积臭气四溢;成本较高等; (2)从化学方程式中得出氨碱法工艺的中循环利用的物质是CO2;氯化铵与生石灰反应生成氨气、氯化钙、水,化学方程式为2NH4Cl+CaO  2NH3↑+CaCl2+H2O; 2NH3↑+CaCl2+H2O;(3)候氏制碱法的原理是向饱和食盐水中通入氨气,再通入二氧化碳可析出碳酸氢钠,所以化学方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl ; (4)因为二氧化碳在水中的溶解度较小,不易生成碳酸氢钠,所以先通入氨气,使溶液呈碱性,再通入二氧化碳可增大二氧化碳的吸收量从而生产碳酸氢钠; (5)碳酸氢钠受热易分解,生成碳酸钠、水和二氧化碳,最终该固体为碳酸钠,所以质量减轻(m1-m2)g,每消耗168g碳酸氢钠,固体质量减轻62g,所以固体中碳酸氢钠的质量是168(m1-m2)/62g,所以样品中碳酸氢钠的质量分数是168(m1-m2)/62/m= 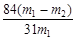 。 。 |
相似问题
把2.1 g CO与H2组成的混合气体与足量的O2充分燃烧后 立即通入足量的Na2O2固体中 固体的
把2 1 g CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )A.2 1 gB.3 6 gC.7 2 gD.无法确定
某兴趣小组的学生根据Mg与CO2反应原理推测钠也能在CO2中燃烧 为了确定其产物并进行实验论证 某同
某兴趣小组的学生根据Mg与CO2反应原理推测钠也能在CO2中燃烧,为了确定其产物并进行实验论证,某同学设计了下列装置进行实验(已知PdCl2能被CO还原得到黑
把钠放入滴有石蕊试液的水中 下列现象不易观察到的是 [ ]A.钠浮在水面上 B.溶液中产生较
把钠放入滴有石蕊试液的水中,下列现象不易观察到的是 [ ]A.钠浮在水面上 B.溶液中产生较多气泡C.水溶液变为蓝色D.钠熔化成小球并在水面游动
根据你对金属钠性质的了解 回答问题: (1)关于钠的叙述中 正确的是( )。 A.钠是银白色
根据你对金属钠性质的了解,回答问题: (1)关于钠的叙述中,正确的是( )。 A.钠是银白色金属,硬度很大 B.将金属钠放在石棉网上,用酒精灯加热后,
将一小块金属钠投到CuSO4溶液中 不可能观察到的现象是[ ]A.溶液中有蓝色沉淀生成B.有
将一小块金属钠投到CuSO4溶液中,不可能观察到的现象是[ ]A.溶液中有蓝色沉淀生成B.有气体生成C.有红色物质析出 D.钠熔成小球浮游在液面上












