以下为在浓盐酸中H3AsO3与SnCl2反应的离子方程式 关于该反应的说法正确的组合是:( )
| 以下为在浓盐酸中H3AsO3与SnCl2反应的离子方程式,关于该反应的说法正确的组合是:( ) a SnCl2+b Cl-+c H3AsO3+d H+=e As+f SnCl62-+g M ①氧化剂是H3AsO3; ②M为OH-; ③每生成7.5gAs,还原剂失去的电子为0.3 mol; ④ SnCl62-是氧化产物。
|
参考解答
| A |
| Sn元素由+2价升至+4价,SnCl62-是氧化产物,而As元素由+3价降至0价,氧化剂是H3AsO3; 由化合价的升降守恒得:3SnCl2+b Cl-+2H3AsO3+d H+=2As+3SnCl62-+g M,再由由电荷守恒及原子守恒可得:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6H2O 故每生成7.5gAs,还原剂SnCl2失去的电子为 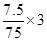 =0.3mol =0.3mol由于溶液为强酸性溶液,M不可能为OH—,排除② 答案为A |
相似问题
印刷电路板是由塑料和铜箔复合而成 刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和Fe
印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式如下: Cu + 2 FeCl3 === CuC
按下列要求各举一例 写出有关的化学方程式 并标出电子转移的方向和数目。(1)氧气氧化一种非金属单质;
按下列要求各举一例,写出有关的化学方程式,并标出电子转移的方向和数目。(1)氧气氧化一种非金属单质;_______________________(2)氢气还原一种非金
某同学为了验证Fe3+是否能氧化H2SO3生成了SO42- 他用50mL0.1mol/LFeCl3溶
某同学为了验证Fe3+是否能氧化H2SO3生成了SO42-,他用50mL0 1mol LFeCl3溶液吸收制取SO2气体的尾气后,进行以下实验:(1)检验吸收液中的SO42-:,证明F
已知:2Fe + 3Br2 = 2FeBr3 Fe2+的还原性大于Br-现有16.8g铁和0.3mo
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-现有16 8g铁和0 3molBr2反应后加入适量水后,通入amolCl2。①.当a≤0 15时,反应离子方程式为②.
下列说法正确的是A.发生化学反应时失去电子越多的金属原子 还原能力越强B.化合反应可能是氧化还原反应
下列说法正确的是A.发生化学反应时失去电子越多的金属原子,还原能力越强B.化合反应可能是氧化还原反应,离子反应不可能是氧化还原反应C.根据反应PbO2












