将128 g铜置入一定量的浓硝酸中 并微热 随着铜的不断减少 反应生成的气体颜色逐渐变浅 当铜反应完
| 将128 g铜置入一定量的浓硝酸中,并微热,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当铜反应完毕时(铜片完全消失),共收集到NO2和NO的混合气体44.8 L气体(标准状况),求: (1)写出上述过程中,有关反应的化学方程式___________、_________________。 (2)完成该反应至少需要量取10 mol/L的浓硝酸_________mL。 (3)混合气体中NO2的体积为 、NO的体积为 。 |
参考解答
| (1)Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O 3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O (2)600 mL (3)V(NO2)= 22.4L V(NO)=' 22.4L' |
试题分析:(1) Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O 3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O 注意方程式的配平,气体箭头符号。 (2)2Cu+6HNO3=2Cu(NO3)2+NO2↑+NO↑+3H2O 根据化学方程式,128 g铜即2molCu,可算出需要10 mol/L的浓硝酸: 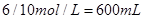 (3) NO2和NO的混合气体44.8 L(标准状况),,即 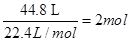 ,即 ,即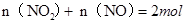 ① ①而128g铜失去电子: 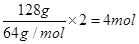 ,则 ,则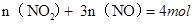 ②,由①②可解出 ②,由①②可解出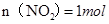 , ,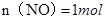 ,即 ,即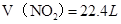 , ,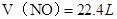 。 。点评:本题综合性较强,考查了铜与浓硝酸、稀硝酸反应的知识点,历年高考常考,计算时应抓住得失电子守恒,化繁为简。 |
相似问题
硫及其化合物有广泛的应用 对SO2性质的研究是高中化学教学的一项重要内容。I.对比研究是一种重要的研
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分
日常生活中的许多现象都与化学反应有关 下列现象与氧化还原反应无关的是( )。A.铁制菜刀生锈B.酸
日常生活中的许多现象都与化学反应有关,下列现象与氧化还原反应无关的是()。A.铁制菜刀生锈B.酸雨腐蚀大理石雕像C.铜制饰品上出现绿色斑点[Cu2(OH)
在室温下 发生下列几种反应:①16H++10Z-+2XO4-===2X2++5Z2+8H2O②2A2
在室温下,发生下列几种反应:①16H++10Z-+2XO4-===2X2++5Z2+8H2O②2A2++B2===2A3++2B-③2B-+Z2===B2+2Z-根据上述反应,判断下列结论错
现榨的苹果汁在空气中会由淡绿色变为棕黄色 其原因可能是( )A.苹果汁中含有Cu2+B.苹果汁中
现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是()A.苹果汁中含有Cu2+B.苹果汁中的Fe2+变成Fe3+C.苹果汁含有OH- D.苹果汁含有Na+
高铁酸钾(K2FeO4)是一种新型 高效 多功能绿色水处理剂 比Cl2 O2 ClO2 KMnO4氧
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高












