硫及其化合物有广泛的应用 对SO2性质的研究是高中化学教学的一项重要内容。I.对比研究是一种重要的研
| 硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。 I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。 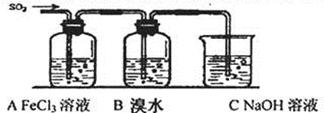 (1)下列实验方案可以用于在实验室制取所需SO2的是 。 A.Na2SO3溶液与HNO3 B.Na2SO3固体浓硫酸 C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸 (2)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO32—):n(HSO3—)变化关系如下表
当吸收液中n(SO32—):n(HSO3—) =10:1时,溶液中离子浓度关系正确的是 。 A.c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—) B.c(Na+)>c(HSO3—)>c(SO32—)>c(OH—)>c(H+) C.c(Na+)>c(SO32—)>c(HSO3—)>c(OH—)>c(H+) (3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
上述方案①得出的结论是否合理 ,原因 。 如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整。 (4)装置B中能表明Br—的还原性弱于SO2的现象是 。 |
参考解答
| (15分) Ⅰ.Na2SO3(2分) Ⅱ. (1)BD(2分) (2) AC (2分) (3)否 (1分) SO2、Fe2+都能使酸性高锰酸钾溶液褪色(2分) 方案②:往第二份试液加入KSCN溶液,观察现象,再加入新制的氯水,(1分)先不变红,后溶液变红。(1分) 方案③:往第三份试液加入稀盐酸酸化,再加入BaCl2溶液(1分) 产生白色沉淀。(1分) (4)B 中橙色(或黄色)褪去(2分) |
试题分析: Ⅰ.第2组中硫元素都为+4价。 Ⅱ.(1)A、HNO3有挥发性,错误; B、可行;C、该方法不适合实验室使用,错误;D、可行 (2)A、符合电荷守恒,正确;B、C比较,当比值为10:1是,溶液呈碱性,说明SO32-浓度比 HSO3-大。 (3)SO2如果和Fe3+发生氧化还原产物为SO42-和Fe2+,因此需要检验这两个离子。 方案①不合理,SO2也能让高锰酸钾褪色。 (4)B 中橙色(或黄色)褪去,说明还原性小于SO2 |
相似问题
日常生活中的许多现象都与化学反应有关 下列现象与氧化还原反应无关的是( )。A.铁制菜刀生锈B.酸
日常生活中的许多现象都与化学反应有关,下列现象与氧化还原反应无关的是()。A.铁制菜刀生锈B.酸雨腐蚀大理石雕像C.铜制饰品上出现绿色斑点[Cu2(OH)
在室温下 发生下列几种反应:①16H++10Z-+2XO4-===2X2++5Z2+8H2O②2A2
在室温下,发生下列几种反应:①16H++10Z-+2XO4-===2X2++5Z2+8H2O②2A2++B2===2A3++2B-③2B-+Z2===B2+2Z-根据上述反应,判断下列结论错
现榨的苹果汁在空气中会由淡绿色变为棕黄色 其原因可能是( )A.苹果汁中含有Cu2+B.苹果汁中
现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是()A.苹果汁中含有Cu2+B.苹果汁中的Fe2+变成Fe3+C.苹果汁含有OH- D.苹果汁含有Na+
高铁酸钾(K2FeO4)是一种新型 高效 多功能绿色水处理剂 比Cl2 O2 ClO2 KMnO4氧
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高
在铜的催化作用下氨气与氟气反应 得到一种三角锥形分子M和一种铵盐Q。下列有关说法错误的是A.该反应的
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐Q。下列有关说法错误的是A.该反应的化学方程式为:4NH3 + 3F2 → NF3 + 3NH4FB












