某金属冶炼厂的管道烟泥中含有炭黑及金属铜 锌 硫.综合实践活动小组的同学设计了从管道烟泥中回收金属铜
某金属冶炼厂的管道烟泥中含有炭黑及金属铜、锌、硫.综合实践活动小组的同学设计了从管道烟泥中回收金属铜并利用废气中的二氧化硫制备硫酸的实验方案,实验过程如图所示: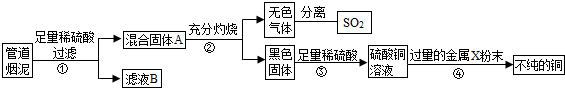 请回答: (1)步骤①中,过滤操作使用了玻璃棒,其作用是______;如何确定硫酸已经过量______. (2)步骤④中,所加入的金属X与Zn的活动性顺序是Zn>X,金属X具有广泛用途,X是______,有关反应的化学方程式______. (3)除去不纯铜中的杂质金属X,可选用的试剂或用品有______(填标号). a.磁铁 b.稀盐酸 c.蒸馏水 d.氯化铜溶液. (4)将分离出的SO2通过下列碘循环工艺过程既能制H2SO4,又能制取H2,其流程如下: 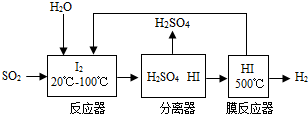 试写出反应器、膜反应器中的化学反应方程式______、______. |
参考解答
| (1)在过滤操作中玻璃棒起到引流的作用,以防止液体飞溅,由于锌的活动性在氢前,铜的活动性在氢后,所以铜锌混合物与稀硫酸反应时,铜不能参与反应,碳也不能反应,而锌与稀硫酸反应会生成硫酸锌,所以过滤时滤液是硫酸锌,固体A是铜与炭黑的混合物,如果加入的硫酸过量时,滤液中会含有硫酸,所以取少量滤液放入试管内,向试管内加入锌粒,如果有气泡产生,说明加入的硫酸是过量的,如果没有气泡产生,说明硫酸没有过量; (2)经过步骤②碳加热生成二氧化碳,铜加热生成氧化铜,氧化铜经步骤③转化成硫酸铜的溶液,硫酸铜加过量的x铜说明x的活动性比铜强,由条件金属X与Zn的活动性顺序是Zn>X,金属X具有广泛用途知X是金属铁,反应是铁与硫酸铜发生置换反应,反应物是铁与硫酸铜写在等号的左边,生成物是铜和硫酸亚铁,写在等号的右边,所以方程式为:CuSO4+Fe═Cu+FeSO4; (3)经过以上过程所得的不纯的铜是铜与未反应的铁粉,用磁铁吸引铁,不能吸引铜,所以能分离,铁和氯化铜反应生成铜和氯化亚铁,铜与氯化铜不反应,所以也能分离,加稀盐酸时铜不能反应而铁能,因此能分离两者,而采用蒸馏水不能分离两者; (4)反应器中的反应物是水、二氧化硫、碘,生成物是硫酸和碘化氢,根据观察法配平即可,所以方程式是:SO2+2H2O+I2═H2SO4+2HI;膜反应器中的反应物是碘化氢生成物是碘和氢气,用观察法配平即可,所以方程式是:2HI
故答案为:(1)引流;取少量滤液放入试管内,向试管内加入锌粒,如果有气泡产生,说明加入的硫酸是过量的,如果没有气泡产生,说明硫酸没有过量;(2)Fe;CuSO4+Fe═Cu+FeSO4;(3)a、b、d;(4)SO2+2H2O+I2═H2SO4+2HI;2HI
|
相似问题
一定温度下 在如图所示装置中 固体X与气体Y反应 生成气态产物;当改变温度时该气态产物发生逆向反应
一定温度下,在如图所示装置中,固体X与气体Y反应,生成气态产物;当改变温度时该气态产物发生逆向反应,重新生成X和Y.利用上述反应原理和装置,对含杂
下列物质制备过程中 不能由一步反应实现的是( )A.KMnO4→O2B.NaCl→NaNO3C.F
下列物质制备过程中,不能由一步反应实现的是( )A.KMnO4→O2B.NaCl→NaNO3C.Fe2O3→Fe(OH)3D.S→SO2
下列物质间的转化 不能一步实现的是( )A.CO→Na2CO3B.CuSO4→Na2SO4C.Fe
下列物质间的转化,不能一步实现的是( )A.CO→Na2CO3B.CuSO4→Na2SO4C.Fe→Fe3O4D.CuCl2→FeCl2
先阅读下列短文 再回答下列问题:在酸性条件下 次氯酸钠(NaClO) 过氧化氢都有很强的氧化性 可将
先阅读下列短文,再回答下列问题:在酸性条件下,次氯酸钠(NaClO)、过氧化氢都有很强的氧化性,可将Fe2+氧化为Fe3+.Mg(OH)2和Fe(OH)3在溶液中生成时呈胶
碳和部分碳的化合物间转化关系如右图所示.(1)物质X的化学式为______ 它的一种用途是_____
碳和部分碳的化合物间转化关系如右图所示.(1)物质X的化学式为______,它的一种用途是______.(2)写出图中转化关系中属于化合反应的一个化学方程式______.












