某反应体系中的物质有KMnO4 FeSO4 H2SO4 Fe2(SO4)3 MnSO4 K2SO4
| 某反应体系中的物质有KMnO4、FeSO4、H2SO4、Fe2(SO4)3、MnSO4、K2SO4、H2O (1)请将除水之外的反应物、产物填入以下横线中 ______+______+______------______+______+______+H2O (2)反应中,被氧化的元素是______,氧化剂是______,还原产物是______ (3)将氧化剂和还原剂填入空格中,并标出电子转移的方向和数目  |
参考解答
| (1)高锰酸钾有强氧化性,所以选高锰酸钾作氧化剂,FeSO4中Fe元素的化合价为+2价,Fe2(SO4)3中Fe元素的化合价为+3价,要选择失电子的物质作还原剂,所以选,FeSO4作还原剂,由高锰酸钾生成硫酸锰需硫酸参加反应,根据反应前后元素守恒,水在生成物中;故答案为:MnSO4 FeSO4 H2SO4 MnSO4 Fe2(SO4)3 K2SO4; (2)反应中被氧化的是化合价升高的铁元素,氧化剂为化合价减低的高锰酸钾,氧化剂被还原为MnSO4; 故答案为:铁;KMnO4;MnSO4; (3)该反应中化合价的变化为:KMnO4→MnSO4,Mn元素由+7价→+2价,一个KMnO4分子得5个电子做氧化剂;FeSO4→Fe2(SO4)3,Fe元素由+2价→+3价,一个FeSO4失去1个电子,做还原剂;依据得失电子的最小公倍数为5,所以KMnO4的计量数为1,FeSO4的计量数为5,即氧化剂和还原剂的定量关系为:2KMnO4+10FeSO4;依据化合价变化和电子守恒得到电子转移为10e-; 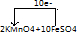 故答案为:氧化剂:KMnO4;还原剂:FeSO4; 电子转移为: 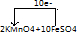 . |
相似问题
钡盐行业生产中排出大量的钡泥[主要含有BaCO3 BaSiO3 BaSO3 Ba(FeO2)2等.某
钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等.某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工
赤铜矿的成分是Cu2O 辉铜矿的成分是Cu2S 将赤铜矿与辉铜矿混合加热有以下反应发生:Cu2S+2
赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应发生:Cu2S+2Cu2O═6Cu+SO2↑,请填写下列空白:(1)在该反应中,氧化剂
在火星上工作的美国“勇气号” “机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息 以
在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水.以下叙述正确的是(
有关氧化还原反应的叙述正确的是( )A.氧化还原反应的实质是有氧元素的得失B.氧化还原反应的实质是
有关氧化还原反应的叙述正确的是( )A.氧化还原反应的实质是有氧元素的得失B.氧化还原反应的实质是元素化合价的升降C.氧化还原反应的实质是电子的
下列变化中 一定需要加入还原剂才可以实现的是( )A.Ag→Ag+B.CO2→H2CO3C.Cl2
下列变化中,一定需要加入还原剂才可以实现的是( )A.Ag→Ag+B.CO2→H2CO3C.Cl2→NaClD.FeCl3→FeCl2












