高锰酸钾(KMnO4)是一种常用的氧化剂。(1)有下列变化:CO32-→CO2 C2O42-→CO2
| 高锰酸钾(KMnO4)是一种常用的氧化剂。 (1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应的离子方程式: 。 (2)高锰酸钾可代替二氧化锰用来制取Cl2,则反应中氧化剂和还原剂的物质的量之比为 。 (3)高锰酸钾与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O。若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生转移的电子数目为 。 |
参考解答
| (1)2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O (2)1∶5 (3)0.15NA(或9.03×1022) |
| (1)MnO4-→Mn2+为还原过程,故与之对应的应为氧化过程C2O42-→CO2。根据得失电子守恒将方程式配平即可。(2)酸性条件下,KMnO4溶液的氧化性较强,其与浓盐酸反应时,被还原为Mn2+,根据电子守恒可知氧化剂和还原剂(HCl)物质的量之比为1∶5。(3)根据方程式可得关系式: 10FeS ~ 10S ~ Δm ~ e- 880 g 320 g 560 g 30 mol 2.8 g n(e-) n(e-)= 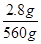 ×30 mol=0.15 mol。 ×30 mol=0.15 mol。 |
相似问题
某离子反应中涉及H2O ClO— NH4+ H+ N2 Cl—六种微粒。其中N2的物质的量随时间变化
某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是:A.该反应的还原剂是Cl—B.
下列变化需要加入氧化剂才能实现的是( )A.HCl→H2B.NaCl→Cl2C.CuSO4→CuD
下列变化需要加入氧化剂才能实现的是( )A.HCl→H2B.NaCl→Cl2C.CuSO4→CuD.HClO→O2
向含有1 mol FeCl2的溶液中通入0.2 mol Cl2 再加入含0.1 mol的酸性溶液 使
向含有1 mol FeCl2的溶液中通入0 2 mol Cl2,再加入含0 1 mol的酸性溶液,使溶液中的Fe2+恰好全部氧化,并使还原为Xn+,则n的值为( )A.2B.3C.4D.5
某工厂利用FeCl3溶液腐蚀镀有铜的绝缘板生产电路板 一实验小组对该厂生产电路后所得的废液进行分析。
某工厂利用FeCl3溶液腐蚀镀有铜的绝缘板生产电路板,一实验小组对该厂生产电路后所得的废液进行分析。取50.0 mL废液,向其中加入0.64 g Cu,金属铜
将11.9 g Mg Al Fe组成的合金溶于足量NaOH溶液中 产生的气体在标准状况下体积为3.3
将11 9 g Mg、Al、Fe组成的合金溶于足量NaOH溶液中,产生的气体在标准状况下体积为3 36 L。另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的












