(14分)某经济开发区将钛冶炼厂与氯碱厂 甲醇厂组成了一个产业链(如图所示) 大大地提高了资源利用率
(14分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。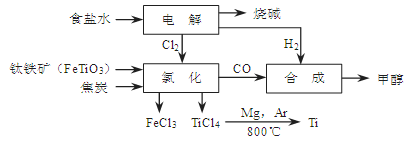 请填写下列空白: (1)写出钛铁矿经氯化得到四氯化钛的化学方程式: 。 (2)由CO和H2合成甲醇是放热的,方程式是:CO(g)+2H2(g) 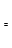 CH3OH(g)。 CH3OH(g)。①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。 ②下图表示合成甲醇反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的甲醇的含量最高的一段时间是 。图中t3时改变的条件可能是 。  (3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图: 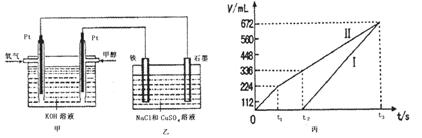 ①写出甲中通入甲醇这一极的电极反应式 。 ②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ,原混合溶液中NaCl的物质的量浓度为 mol/L。(假设溶液体积不变) |
参考解答
| ⑴ 2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO(2分) ⑵① 向逆反应方向进行(2分) ②t2~t3 (2分)升高温度 (2分) (3)①CH3OH-6e-+8OH-=CO32-+6H2O(2分) ②4OH--4e-=O2↑+2H2O (2分) 0.1(2分) |
试题分析:⑴据流程图,钛铁矿氯化过程中反应物有FeTiO3、C、Cl2、,生成物有FeCl3、TiCl4、CO,然后根据氧化还原反应的配平方法将其配平。 ⑵①此时该反应的浓度商Qc= 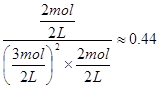 >0.27(K),说明反应向逆反应方向进行; >0.27(K),说明反应向逆反应方向进行;②结合反应[CO(g)+2H2(g)  CH3OH(g),正反应放热,并据图可确定“t1~t2”是加压,“t3~t4”是加热(升高温度),“t5~t6”是加催化剂;在t2~t3时间段内平衡混合物中的甲醇的含量最高。 CH3OH(g),正反应放热,并据图可确定“t1~t2”是加压,“t3~t4”是加热(升高温度),“t5~t6”是加催化剂;在t2~t3时间段内平衡混合物中的甲醇的含量最高。⑶①装置甲为甲醇燃料电池,通入甲醇一极为负极,先根据得失电子守恒有CH3OH-6e-――CO32-,再根据电荷守恒有CH3OH-6e-+8OH―――CO32-,最后根据原子守恒得CH3OH-6e-+8OH-=CO32-+6H2O。 ②装置乙为电解池,铁电极为阴极,该极发生的电极反应依次为Cu2++2e-=Cu,2H++2e-=H2↑;石墨为阳极,该极发生的电极反应式依次为2Cl--2e-=Cl2↑,4OH--4e-=O2↑+2H2O;据此可确定在t1后,石墨电极上的电极反应式为4OH--4e-=O2↑+2H2O;根据在t1前发生的电极反应“2Cl--2e-=Cl2↑”可计算原混合溶液中NaCl的物质的量浓度: 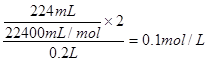 。 。 |
相似问题
对于反应3Cl2+6NaOH5NaCl+NaClO3+3H2O 以下叙述正确的是A.Cl2是氧化剂
对于反应3Cl2+6NaOH5NaCl+NaClO3+3H2O,以下叙述正确的是A.Cl2是氧化剂,NaOH是还原剂B.当有6 72L Cl2反应时,转移电子物质的量为0 5molC.氧化剂得电
近年来地质 环境灾难频频发生 为防止在大灾之后疫病流行 灾区需要大量的各种消毒剂 漂白剂等。(1)二
近年来地质、环境灾难频频发生,为防止在大灾之后疫病流行,灾区需要大量的各种消毒剂、漂白剂等。(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱
已知MO4x-+2SO32-+4H+=M2++2SO42-+2H2O 则MO4x-中的M的化合价为[
已知MO4x-+2SO32-+4H+=M2++2SO42-+2H2O,则MO4x-中的M的化合价为[ ]A.+2B.+3 C.+4 D.+6
已知+bH++cCl-═dR2++5Cl2↑+8H2O 则中R的化合价为[ ]A.+4 B.
已知+bH++cCl-═dR2++5Cl2↑+8H2O,则中R的化合价为[ ]A.+4 B.+5C.+6D.+7
(I)在铝热反应 Fe2O3+2Al 高温 . 2Fe+Al2O3 中 作为氧化剂的物质是_____
(I)在铝热反应Fe2O3+2Al高温 2Fe+Al2O3中,作为氧化剂的物质是______(填化学式),作为还原剂的物质是______(填化学式);(II)Zn粒和稀盐酸反应一












