某化学兴趣小组为探究Cl2 Br2 Fe3+的氧化性强弱 设计了如下实验:①检查气体发生装置A的气密
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验: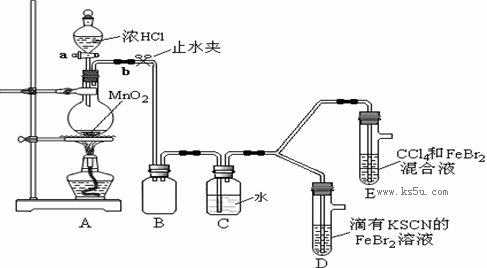 ①检查气体发生装置A的气密性的操作是 。 ②整套实验装置存在一处明显的不足,请指出: 。 (2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。 D装置中:红色慢慢褪去。 E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。 为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因: , 请设计简单实验证明上述解释: 。 ②欲探究E中颜色变化的原因,设计实验如下: 用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因: 。 ③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为 。 |
参考解答
| (1)①方法一:关闭活塞a,打开止水夹b,将长导管末端浸入水中,用手捂住圆底烧瓶,导管口有 泡;松开手后,有水进入导管,则气密性良好。 或:方法二:关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好。 ②缺少尾气处理装置。 (2)Cl2>Br2>Fe3+ (3)①过量氯气和SCN –反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则 Fe3++3SCN-  Fe(SCN)3 平衡逆向移动而褪色。 Fe(SCN)3 平衡逆向移动而褪色。取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理。(或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理。(其它合理答案也得分) ② BrCl+H2O=HBrO+HCl反应只产生Cl-,不产生Br-。 ③ BrCl+2KI=KCl+KBr+I2 写分步反应的方程式也可 |
试题分析:本题探究氧化性的强弱,用强制弱的原理进行相关的实验。这个实验的流程为制取氯气→收集(安全瓶)→净化氯气(除HCl)→然后进行实验。在两组实验中可以对比是先氧化Fe2+还是Br-。从而得到相关的结论。 |
相似问题
已知I- Fe2+ SO2 Cl-均有还原性 它们还原性的强弱顺序是:SO2>I->Fe2+>Cl-
已知I-、Fe2+、SO2、Cl-均有还原性,它们还原性的强弱顺序是:SO2>I->Fe2+>Cl-,则下列反应不能发生的是( )A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+B
R X Y和Z是四种常见的金属.已知XSO4与单质R不反应;XSO4+Z=X+ZSO4;Y+ZSO4
R、X、Y和Z是四种常见的金属.已知XSO4与单质R不反应;XSO4+Z=X+ZSO4;Y+ZSO4=YSO4+Z.四种金属的还原性顺序正确的是( )A.R>X>Y>ZB.X>R>Y>Z
根据①Fe+Cu2+=Fe2++Cu②2Fe3++Cu=Cu2++2Fe2+③2Fe2++Cl2=2
根据①Fe+Cu2+=Fe2++Cu②2Fe3++Cu=Cu2++2Fe2+③2Fe2++Cl2=2Fe3++2Cl-④HClO+H++Cl-=Cl2+H2O可以判断出氧化性由强到弱的顺序是( )A.HClO>Cl2>Fe3+
判断氧的非金属性比硫强的事实是( )A.氢硫酸敞口放置于空气中变浑浊B.常温下Hg不与O2反应而与
判断氧的非金属性比硫强的事实是()A.氢硫酸敞口放置于空气中变浑浊B.常温下Hg不与O2反应而与硫粉反应C.Fe在氧气中燃烧生成Fe3O4,而与硫反应生成FeS
常温下 H2O2溶液中滴加少量FeSO4溶液 可发生如下反应:2Fe2++H2O2+2H+=2Fe3
常温下,H2O2溶液中滴加少量FeSO4溶液,可发生如下反应:2Fe2++H2O2+2H+=2Fe3++2H2O,下列说法正确的是()A.Fe2+得电子B.H2O2被氧化C.H2O2的氧化性












