对实验过程中出现的异常现象进行探究 是实施素质教育 培养创新精神的有效途经。【实验1】用下图实验装置
| 对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经。 【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验: 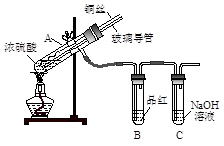  (1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是 。 (2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有 。 (3)确定乙是否煅烧完全的操作是 。 (4)煅烧过程中一定发生的化学反应方程式为 。 【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。 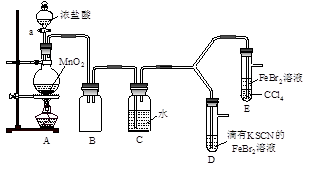 (5)根据下列实验操作和现象,填写实验结论。
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。 为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因____ ; 请设计简单实验证明上述解释 。 ②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因 。 |
参考解答
| (本题共12分)(1)在熄灭酒精灯后,B中的液体不会倒吸(1分) (2)泥三角、坩埚(坩埚钳)(2分,坩埚钳不写不扣分) (3)重复操作(再煅烧、冷却、称量),直至恒重(前后两次称量差不超过0.001g)。(2分) (4)2CuS+3O2  2CuO+2SO2 (2分) (5)Cl2 >Br2 >Fe3+(1分) 2CuO+2SO2 (2分) (5)Cl2 >Br2 >Fe3+(1分)(6)①过量氯气和SCN –反应:2SCN-+Cl2→2Cl-+(SCN)2,使SCN-浓度减小,则Fe3+ +3SCN-  Fe(SCN)3 平衡逆向移动而褪色(2分);取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理。(或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理。(其它合理答案也得分)(1分) Fe(SCN)3 平衡逆向移动而褪色(2分);取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理。(或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理。(其它合理答案也得分)(1分)②BrCl + H2O →HBrO + HCl反应只产生Cl-,不产生Br-(1分) |
试题分析:(1)SO2极易溶于水,所以容易引起倒吸。由于B装置和A装置之间连接有橡皮管,所以该装置的另外一个特点是在熄灭酒精灯后,B中的液体不会倒吸。 (2)固体灼烧应该在坩埚中进行,所以还需要的仪器有泥三角、坩埚(坩埚钳)。 (3)要检验固体灼烧是否完全的正确操作应该是重复操作(再煅烧、冷却、称量),直至恒重(前后两次称量差不超过0.001g)。 (4)由于固体乙灼烧后固体质量减少,所以固体乙中一定含有CuS,因为Cu2S灼烧后固体质量不变,所以灼烧时反应的化学方程式是2CuS+3O2  2CuO+2SO2。 2CuO+2SO2。(5)A装置中产生氯气,D装置中溶液变红,这说明反应中有Fe3+生成,即氯气将亚铁离子转化为铁离子。E装置中水层溶液变黄,振荡后,CCl4层无明显变化,这说明反应中氯气首先氧化亚铁离子,所以根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性可知,氧化性强弱顺序是Cl2 >Br2 >Fe3+。 (6)①因为氧化性是Cl2>(SCN)2,所以过量氯气和SCN-反应:2SCN-+Cl2→2Cl-+(SCN)2,使SCN-浓度减小,则可逆反应Fe3++3SCN-  Fe(SCN)3 平衡逆向移动而褪色。要证明上述结论,可以根据平衡移动原理,即取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理。(或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理。 Fe(SCN)3 平衡逆向移动而褪色。要证明上述结论,可以根据平衡移动原理,即取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理。(或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理。②由于过量的Cl2和Br2反应生成的BrCl,BrCl与水发生水解反应生成盐酸和次溴酸,反应的方程式是BrCl + H2O →HBrO + HCl。反应只产生Cl-,不产生Br-,所以只能得到白色沉淀氯化银,得不到溴化银浅黄色沉淀。 |
相似问题
(8分)在酸性条件下:①KBrO3能将KI氧化成I2或KIO3 其本身被还原成Br2;②KIO3能将
(8分)在酸性条件下:①KBrO3能将KI氧化成I2或KIO3,其本身被还原成Br2;②KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原成I2。(1)上述反
都具有氧化性 其氧化性 能把溴从溴化物中置换出来 其余依次类推。向 的混合液中 通入一定量氯气后 将
都具有氧化性,其氧化性,能把溴从溴化物中置换出来,其余依次类推。向、的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成
根据反应:2H2S+O2=2S↓+2H2O 4NaI+O2+2H2SO4=2I2+2Na2SO4+2
根据反应:2H2S+O2=2S↓+2H2O、4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O Na2S+I2=2NaI+S↓,判断下列物质的氧化性强弱,正确的是: ( )A.O2>I2>SB.H2S>NaI>
根据反应式:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Fe3++2Br
根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Fe3++2Br-,判断下列离子的还原性由强到弱的顺序是( )A.Br-、Fe2+、I-B.I-、Fe2+、Br-C.Br-、I-、Fe2+D.Fe2+、I-、Br-
根据反应方程式① 2Fe3+ +2I― ='=' 2Fe2+ + I2 ② 2Fe2+ +Br2
根据反应方程式① 2Fe3+ +2I― ="=" 2Fe2+ + I2② 2Fe2+ +Br2 ="=" 2Fe3+ +2Br- ,可判断离子的还原性从强到弱的顺序正确的是A.Br->Fe












