工业上以铬铁矿(主要成分为FeO·Cr2O3) 碳酸钠 氧气和硫酸为原料生产重铬酸钠(Na2Cr2O
| 工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠 (Na2Cr2O7·2H2O),其主要反应:( ) ①4FeO·Cr2O3+8Na2CO3+7O2 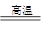 8Na2CrO4+2Fe2O3+8CO2 ②2Na2CrO4+H2SO4 8Na2CrO4+2Fe2O3+8CO2 ②2Na2CrO4+H2SO4 Na2SO4+Na2Cr2O7+H2O Na2SO4+Na2Cr2O7+H2O下列说法不正确的是( )
|
参考解答
| A |
| 反应①为氧化还原反应,反应②不是,A错误;根据氧化剂的氧化性大于氧化产物的氧化性,知O2的氧化性应大于Fe2O3和Na2CrO4的,C正确;考虑到反应②是一个可逆反应,反应中生成1 mol Na2Cr2O7时,转移电子的物质的量应大于7 mol,D正确;同时可以看出,加碱可以使平衡左移,B正确。 |
相似问题
在3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O 中 还原产物和氧化产物的物质的
在3Cl2+6KOH=KClO3+5KCl+3H2O中,还原产物和氧化产物的物质的量之比为 [ ]A.1︰5B.1︰3C.5︰1D.3︰1
将SO2气体与足量Fe2(SO4)3溶液完全反应后 再加入K2Cr2O7溶液 发生如下两个化学反应:
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+②Cr2O72-+6Fe2++14H
下列变化中加入氧化剂才能发生的是[ ]A.2Cl-→Cl2 B.Fe3+→Fe2+C.Cu2
下列变化中加入氧化剂才能发生的是[ ]A.2Cl-→Cl2 B.Fe3+→Fe2+C.Cu2+→CuD.MnO4-→MnO2
已知某溶液中Cl- Br- I-的物质的量之比为2∶3∶4 现欲使溶液中的Cl- Br- I-的物质
已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比改变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中
下列叙述中能肯定A金属比B金属金属性强的是 ( )A.A原子的最外层电子数比B原子的最外层电
下列叙述中能肯定A金属比B金属金属性强的是 ( )A.A原子的最外层电子数比B原子的最外层电子数少B.A原子的电子层数比B原子的电子层数多C.1mol A从酸












