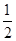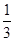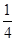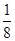已知某溶液中Cl- Br- I-的物质的量之比为2∶3∶4 现欲使溶液中的Cl- Br- I-的物质
已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比改变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中I-的物质的量的 ( )。
|
参考解答
| C |
| 设原溶液中Cl-、Br-、I-的物质的量分别为2 mol、3 mol、4 mol,则根据离子方程式Cl2+2I-=I2+2Cl-,可知只要通入1 mol Cl2就可使溶液中的I-由4 mol降到2 mol,而Cl-由2 mol增至4 mol,而Br-的物质的量保持不变,仍为3 mol,所以通入的Cl2与原溶液中I-的物质的量之比为1∶4。I-、Br-、Cl-都有还原性,且还原性依次减弱。通Cl2时,Cl2先氧化I-,当I-完全被氧化后才能再氧化Br-。 |
相似问题
下列叙述中能肯定A金属比B金属金属性强的是 ( )A.A原子的最外层电子数比B原子的最外层电
下列叙述中能肯定A金属比B金属金属性强的是 ( )A.A原子的最外层电子数比B原子的最外层电子数少B.A原子的电子层数比B原子的电子层数多C.1mol A从酸
某一反应体系中有反应物和生成物共5种物质:S H2S HNO3 NO H2O。该反应中还原产物是__
某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是___________;若反应过程中转移了0 3电子,则氧化产物的质量是__________。
把SO2通入Fe(NO3)3溶液中 溶液由棕色变为浅绿色 但立即又变为棕黄色 这时若滴入BaCl2溶
把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是[
钾的冶炼可采用如下方法:2KF+CaC2CaF2+2K↑+2C 下列有关说法合理的是[ ]A
钾的冶炼可采用如下方法:2KF+CaC2CaF2+2K↑+2C,下列有关说法合理的是[ ]A.当转移1 mol电子时,生成39 g钾 B.该反应说明碳的还原性比钾的强C.
下列实验方案不能达到预期目的的是( )A.用钠 镁分别与水反应 可证明钠 镁的金属性强弱B.
下列实验方案不能达到预期目的的是()A.用钠、镁分别与水反应,可证明钠、镁的金属性强弱B.用氯化镁、氯化铝分别于浓氨水反应,可证明钠、镁的金属性