原子序数由小到大排列的四种短周期元素X Y Z W 四种元素的原子序数之和为32 在周期表中X是原子
| 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。 (1)X元素是 (填名称) ,W在周期表中的位置 。 (2)X与Y 形成化合物的电子式为 ,X与W组成的化合物中存在 键(填“离子”“共价”)。 (3)①写出实验室制备YX3的化学方程式: 。 ②工业上也可以选择合适的条件进行YX3的合成,若已知在该条件下每生成2molYX3气体时放出 92.4kJ的热量,写出该反应的热化学方程式 。 (4)由X、Y、Z、W四种元素组成的一种离子化合物A。已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。则A的名称是 。 |
参考解答
| (1)H 第三周期第ⅥA族 (2) 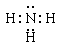 共价 共价(3)①2NH4Cl + Ca(OH)2  CaCl2 + 2NH3↑+ 2H2O CaCl2 + 2NH3↑+ 2H2O②N2(g)+3H2(g)  2NH3(g) △H=-92.4KJ/mol 2NH3(g) △H=-92.4KJ/mol(4)硫酸铵或亚硫酸铵 |
试题分析:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素。 (1)由上述分析可知,X元素是H元素,W是硫元素,位于元素周期表的第三周期第ⅥA族,故答案为:H;第三周期第ⅥA族。 (2)X与Y 形成的化合物是氨气,含有极性键的共价化合物,电子式为 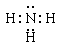 。X与W组成的化合物是H2S,分子中H、S之间以共用电子对形成化合物,则以共价键结合,故答案为:共价; 。X与W组成的化合物是H2S,分子中H、S之间以共用电子对形成化合物,则以共价键结合,故答案为:共价;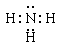 。 。(3)①实验室制备氨气是用熟石灰和氯化铵加热,反应的化学方程式为2NH4Cl + Ca(OH)2  CaCl2 + 2NH3↑+ 2H2O。 CaCl2 + 2NH3↑+ 2H2O。②每生成2mol氨气气体时放出92.4kJ的热量,则该反应的热化学方程式为N2(g)+3H2(g)  2NH3(g) △H=-92.4KJ/mol。 2NH3(g) △H=-92.4KJ/mol。(4)X、Y、Z、W四种元素组成的一种离子化合物中的阳离子为NH4+,阴离子为硫酸根离子、硫酸氢根离子、亚硫酸根离子、亚硫酸氢根离子,但1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体,则1molA中含有2molNH4+,则A为硫酸铵或亚硫酸铵。 |
相似问题
将下列物质按照要求由高到低的顺序排列(1)NaF NaCl 冰醋酸 SiC四种物质的熔沸点顺序:
将下列物质按照要求由高到低的顺序排列(1)NaF、NaCl、冰醋酸、SiC四种物质的熔沸点顺序:。(2)C、N、O三种元素的第一电离能:。(3)H2O的相对分子质
元素R X T Z Q在元素周期表中的相对位置如下表所示 其中R单质在暗处与H2剧烈化合并发生爆炸
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是A.非金属性:Z<T<XB.R与Q的电
核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域.已知只有质子数或中子数为
核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域.已知只有质子数或中子数为奇数的原子核有NMR现象.试判断下列哪组原子均可产
如图为元素周期表中短周期的一部分 四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( ) A.原子半径:W>Z>Y>XB.气态氢化
元素的种类和原子的种类( )。A.前者多B.后者多C.相同D.无法确定
元素的种类和原子的种类( )。A.前者多B.后者多C.相同D.无法确定












