向NaBr与NaI的混合溶液中通入适量Cl2 反应完全后将溶液蒸干并小心灼烧至恒重 得固体W。(1)
| 向NaBr与NaI的混合溶液中通入适量Cl2,反应完全后将溶液蒸干并小心灼烧至恒重,得固体W。 (1)W的可能组成为①____________;②________;③____________;④____________。(填化学式,可以多填或少填) (2)现将NaBr与NaI的混合固体10.0 g溶于适量水中,通入448 mL Cl2(标准状况)充分反应后,按上述操作得到W的质量为7.28 g。求原混合物中NaI的质量分数。 |
参考解答
| (1)①NaCl ②NaCl、NaBr ③NaCl、NaBr、NaI (2)30.0% |
| (1)在混合液中通入Cl2,可发生如下反应: 2NaI+Cl2====2NaCl+I2;2NaBr+Cl2====2NaCl+Br2。 因I-比Br-的还原性强,故通入Cl2时,Cl2优先与还原性强的I-反应。灼烧时I2易升华,Br2易挥发。 当Cl2把NaI、NaBr全部氧化时,灼烧至恒重得到NaCl;当Cl2使NaI反应完全而使NaBr未反应或部分反应时,得到的固体为NaCl和NaBr的混合物;当Cl2的量很少,只能使部分NaI氧化时,燃烧所得固体为NaCl、NaBr、NaI三者的混合物。因此,W的组成可能有三种,即①NaCl,②NaCl、NaBr,③NaCl、NaBr、NaI。 (2)n(Cl2)= 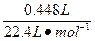 ='0.0200' mol ='0.0200' mol①若Cl2完全反应,消耗原固体的最大质量为 mmax=m(NaI)=2×0.0200 mol×150 g\5mol-1='6.00' g<10.0 g 所以,Cl2的量不足,将完全转化为NaCl。 根据氯元素守恒生成的NaCl应为: m(NaCl)='0.0200' mol×2×58.5 g·mol-1='2.34' g,所以W中含NaCl 2.34 g。 ②如果Cl2 0.0200 mol全部与NaI反应,固体质量减少, Δm='6.00' g-2.34 g='3.66' g>10.0 g-7.28 g='2.72' g ③若Cl2 0.0200 mol完全与NaBr反应,需NaBr的质量为: m(NaBr)=2×0.0200 mol×103 g\5mol-1='4.12' g 固体质量减少Δm='4.12' g-2.34 g='1.78' g<10.0 g-7.28 g='2.72' g。 由此可推知Cl2与NaI反应完全,而与NaBr部分反应。所以7.28 g固体W为NaCl和NaBr的混合物。 设原固体混合物中NaI的物质的量为x。 Cl2+2NaI====I2+2NaCl Δm 1 mol 183 g 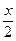 Cl2+2NaBr====Br2+2NaCl Δm 1 mol 89 g 0.0200 mol- 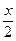 依题意可列方程: 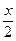 ×183 g·mol-1+(0.0200 mol- ×183 g·mol-1+(0.0200 mol-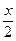 )×89 g·mol-1='10.0' g-7.28 g,解得x='0.0200' mol。 )×89 g·mol-1='10.0' g-7.28 g,解得x='0.0200' mol。w(NaI)= 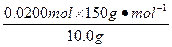 ×100%=30.0% ×100%=30.0%答:原混合物中的NaI质量分数为30.0%。 |
相似问题
下列叙述中正确的是……( ) A.氯水 亚硫酸 活性炭的漂白或脱色原理虽然不同 但它们都能使品红或墨
下列叙述中正确的是……( ) A.氯水、亚硫酸、活性炭的漂白或脱色原理虽然不同,但它们都能使品红或墨迹褪色; B.将等物质的量的Cl2和SO2同时与潮
漂白粉和泡腾片用于环境消毒和饮用水消毒 已知泡腾片消毒原理如下图:下列有关说法不正确的是A.漂白粉需
漂白粉和泡腾片用于环境消毒和饮用水消毒,已知泡腾片消毒原理如下图:下列有关说法不正确的是A.漂白粉需密闭储存B.工业上制取漂白粉可将氯气通入石灰
将氯气通入溴化亚铁溶液后 再加入四氯化碳并振荡 静置。整个实验过程中肯定能观察到的现象是( )A.
将氯气通入溴化亚铁溶液后,再加入四氯化碳并振荡、静置。整个实验过程中肯定能观察到的现象是( )A.上层显黄棕色B.下层显红棕色C.下层显无色D.在
为了研究氯水能否和碳酸钙发生化学反应 某学生设计如下实验:实验一:在不加热的情况下用右图装置制取氯气
为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:实验一:在不加热的情况下用右图装置制取氯气,已知A是HCl,B为固体,则B可能是______(写
下列物质中 不能使品红溶液褪色的是( )A.Cl2B.HClC.SO2D.活性炭
下列物质中,不能使品红溶液褪色的是( )A.Cl2B.HClC.SO2D.活性炭












