为了研究氯水能否和碳酸钙发生化学反应 某学生设计如下实验:实验一:在不加热的情况下用右图装置制取氯气
| 为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验: 实验一:在不加热的情况下用右图装置制取氯气,已知A是HCl,B为固体,则B可能是______(写物质名称,任写一种即可),该反应的化学方程式为: 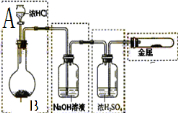 ______ 实验二:用图除去氯气中的杂质,洗气装置内的洗涤液一般用______溶液.某同学用图装置为了获得较大浓度的氯水,他将进气导管末端连一多孔的球泡,在装置右边气体出口导管处连一干瘪的橡皮气囊,请说明理由: ______. 实验三:将制得的氯水转移到锥形瓶中,再加入大理石,并充分振荡,观察到氯水的黄绿色褪去,同时产生少量气体.分别取锥形瓶中上层清液4份,进行如下实验,请用化学式填空: (1)该清液滴在有色布条上有极强的漂白作用.说明该清液中含有______(写化学式); (2)该清液中滴加碳酸钠溶液产生白色沉淀.说明该清液中含有______离子; (3)该清液中滴加盐酸可产生大量气体.该气体是______; (4)该清液加热后变浑浊并产生大量气体.加热后产生浑浊的原因是因为生成了______. (5)通过上述实验,请写出氯水和碳酸钙反应的化学方程式为:______.  |
参考解答
| 实验一:实验室制氯气的原理是隐含浓盐酸中的氯离子,在不加热的情况下用右图装置制取氯气,氧化剂可以选高锰酸钾不加热可以反应生成氯气,所以反应的化学方程式为: 2KMnO4+8HCl=2MnCl2+2KCl+Cl2↑+4H2O,故答案为:高锰酸钾;2KMnO4+8HCl=2MnCl2+2KCl+Cl2↑+4H2O; 实验二:氯气中含有的杂质主要是氯化氢、水蒸气,除去氯气中的杂质,洗气装置内的洗涤液应是,饱和食盐水除去氯化氢,浓硫酸除去水蒸气,进气导管末端连一多孔的球泡,增大气体与溶液的接触面积,使反应充分进行;在装置右边气体出口导管处连一干瘪的橡皮气囊,氯气有毒污染空气,防止氯气排放,橡皮气囊起到储存气体,平衡压强的作用, 故答案为:饱和食盐水、浓硫酸;增大气体与溶液的接触面积,使反应充分进行,氯气有毒污染空气,防止氯气排放,橡皮气囊起到储存气体,平衡压强; 实验三:(1)清液滴在有色布条上有极强的漂白作用.说明该清液中含有具有漂白性的次氯酸,故答案为:HClO; (2)清液中滴加碳酸钠溶液产生白色沉淀.说明该清液中含有钙离子,生成沉淀碳酸钙,故答案为:Ca2+; (3)清液中滴加盐酸可产生大量气体,碳酸钙是过量的,碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙,滴入盐酸生成气体为二氧化碳,故答案为:CO2; (4)清液加热后变浑浊并产生大量气体.加热后产生浑浊的原因是因为溶液中的碳酸氢钙分解生成碳酸钙水和二氧化碳,生成了沉淀碳酸钙,故答案为:CaCO3; (5)根据实验三(1)-(4)实验步骤发生的反应和物质判断可知氯水和碳酸钙反应的化学方程式为2CaCO3+2Cl2+H2O=CaCl2+Ca(HCO3)2+2HClO, 故答案为:2CaCO3+2Cl2+H2O=CaCl2+Ca(HCO3)2+2HClO. |
相似问题
下列物质中 不能使品红溶液褪色的是( )A.Cl2B.HClC.SO2D.活性炭
下列物质中,不能使品红溶液褪色的是( )A.Cl2B.HClC.SO2D.活性炭
下列关于物质性质的叙述中 正确的是A.浓硫酸具有吸水性 能使胆矾晶体由蓝变白B.同温同物质的量浓度的
下列关于物质性质的叙述中,正确的是A.浓硫酸具有吸水性,能使胆矾晶体由蓝变白B.同温同物质的量浓度的Na2CO3溶液和NaHCO3溶液,前者的碱性弱C.过量铁
写出下列制取氯气的化学反应方程式:(1)实验室用二氧化锰跟浓盐酸反应制取氯气的化学反应方程式为___
写出下列制取氯气的化学反应方程式:(1)实验室用二氧化锰跟浓盐酸反应制取氯气的化学反应方程式为_____________________。(2)高锰酸钾(KMnO4)是常用的氧
欲除去氯气中少量的氯化氢气体 可选用的试剂是( )A.饱和食盐水B.硝酸银溶液C.氢氧化钠溶液D.
欲除去氯气中少量的氯化氢气体,可选用的试剂是( )A.饱和食盐水B.硝酸银溶液C.氢氧化钠溶液D.饱和碳酸钠溶液
下列有关实验现象的叙述 不正确的是( )A.氢气在氯气中燃烧 发出苍白色火焰B.铁丝在氯气中燃烧
下列有关实验现象的叙述,不正确的是( )A.氢气在氯气中燃烧,发出苍白色火焰B.铁丝在氯气中燃烧,生成红棕色烟C.钠在氯气中燃烧,生成白色的烟D












