(12分)【化学——物质结构与性质】铜单质及其化合物在很多领域有重要用途 如金属铜用来制造电线电缆
| (12分)【化学——物质结构与性质】 铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,无水合硫酸铜可用作杀菌剂等。 (1)Cu2+的核外电子排布式为________________。 (2)科学家通过X射线测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下: 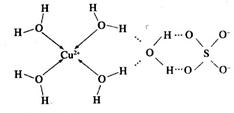 ①胆矾的化学式用配合物的形式表示为______。 ②胆矾中 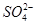 的空间构型为_________,H2O中O原子的杂化方式为____________。 的空间构型为_________,H2O中O原子的杂化方式为____________。(3)向硫酸铜溶液中加入过量氨水,可生成 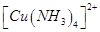 配离子。已知 配离子。已知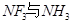 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。(4) 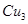 N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。 N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。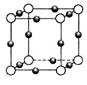 |
参考解答
| (1)[Ar3d9 (2)①[Cu(H2O)4SO4·H2O ②正四面体型 sp3 (3)F的电负性比N大,N-F成键电子对偏向F原子,使得氮原子上的孤对电子难与Cu2+形成配离子 (4)6 206/a3b |
试题分析:(1)铜为29号元素,其基态原子核外电子排布为[Ar3d104s1,其中3d和4s轨道分别为全充满和半充满,故Cu2+的核外电子排布为[Ar3d9;(2)根据胆矾的结构示意图可知Cu2+与4个H2O中的氧原子形成配位键,且其中的2个水分子又与另外一个H2O以氢键结合,然后再与硫酸根以氢键结合,故可表示为:[Cu(H2O)4SO4·H2O;根据图示可知胆矾中 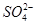 的空间构型应为正四面体型,H2O中O原子的杂化方式为sp3;(3)因为F的电负性比N大,N-F成键电子对偏向F原子,使得氮原子上的孤对电子难与Cu2+形成配离子;(4)根据晶胞结构可知顶点位置为N3-,楞上为Cu+,故N3-的配位数是6;1个晶胞中含有3个Cu+和1个N3—,故1个晶胞的质量为206/NA g,体积为a3 cm3,所以密度bg/cm3=206/NA g÷a3 cm3,故NA=206/a3b。 的空间构型应为正四面体型,H2O中O原子的杂化方式为sp3;(3)因为F的电负性比N大,N-F成键电子对偏向F原子,使得氮原子上的孤对电子难与Cu2+形成配离子;(4)根据晶胞结构可知顶点位置为N3-,楞上为Cu+,故N3-的配位数是6;1个晶胞中含有3个Cu+和1个N3—,故1个晶胞的质量为206/NA g,体积为a3 cm3,所以密度bg/cm3=206/NA g÷a3 cm3,故NA=206/a3b。 |
相似问题
(15分)铜是过渡金属元素 可以形成多种化合物。(1)CuCl的盐酸溶液能够与CO发生反应:CuCl
(15分)铜是过渡金属元素,可以形成多种化合物。(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O①电负性:C ______O(填“>”或“
核反应堆通常使用235U和239Pu作为原料 研究和开发核能可以减少对化石燃料的依赖。下列有关说法正
核反应堆通常使用235U和239Pu作为原料,研究和开发核能可以减少对化石燃料的依赖。下列有关说法正确的是A.239Pu比235U原子核内多4个中子B.核反应堆中使
已知短周期主族元素A B在周期表中的相对位置如右图(稀有气体除外) 则下列说法不正确的是 AB A
已知短周期主族元素A、B在周期表中的相对位置如右图(稀有气体除外),则下列说法不正确的是ABA.A一定是第2周期元素 B.B的原子半径一定比A大C.B的金
(12分)【选做题】本题包括A B两小题 请选定其中一小题 并在相应的答题区域内作答。若多做 则按A
(12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。A.[物质结构与性质]下表为元素周期表的
短周期元素X Y Z W Q在元素周期表中的相对位置如图所示。下列说法正确的是 ( )A.元
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是()A.元素X与元素Z的最高正化合价之和的数值等于8B.原子半径的大小顺序












