研究物质间的氧化还原反应有重要的意义。(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制
| 研究物质间的氧化还原反应有重要的意义。 (1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是___________;生成0.5molK2FeO4转移电子的物质的量____________mol。 (2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为: 3Zn(OH)2+2Fe(OH)3+4KOH 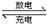 3Zn+2K2FeO4+8H2O 3Zn+2K2FeO4+8H2O放电时,电池的负极反应式为____________。充电时电解液的pH____________(填“增大”“不变”或“减小”) (3)H2O2是一种绿色氧化剂。工业制备H2O2的原理如下: ①电解池总反应:2S2O42?+2H+═S2O82-+H2↑ ②电解生成的S2O82-水解:S2O82-+2H2O═H2O2+2H++SO42? 电解池中阴极反应式____________。 |
参考解答
| (1)KClO;1.5mol(2)Zn+2OH--2e-=Zn(OH)2;减小(3)2H++2e-=H2↑ |
试题分析:(1)该反应中,铁元素的化合价由+3价变为+6价,氯元素化合价由+1价变为-1价,所以氢氧化铁是还原剂,次氯酸钾是氧化剂,生成0.5mol K2FeO4转移的电子的物质的量=0.5mol×(6-3)=1.5mol,答案为:KClO,1.5;(2)该原电池放电时,负极上锌失电子和氢氧根离子反应生成氢氧化锌,电极反应式为:Zn+2OH--2e-=Zn(OH)2,充电时,氢氧根离子参加反应生成水,所以随着反应的进行,氢氧根离子浓度减小,溶液的pH减小,答案为:Zn+2OH--2e-=Zn(OH)2[或3Zn+6OH--6e-=3Zn(OH)2或Zn+2OH-=Zn(OH)2+2e-均合理,减小;(3)电解时阴极上得电子发生还原反应,根据电池反应式知,氢离子得电子发生还原反应,所以阴极上的电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑. |
相似问题
(14分)黄铜矿是工业炼铜的主要原料 其主要成分为CuFeS2 现有一种天然黄铜矿(含少量脉石SiO
(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:现称取
Na2FeO4是一种高效多功能水处理剂 一种制备Na2FeO4的方法可用化学方程式表示如下:2FeS
Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2+O2↑。下列对此反应的说法中,不
某金属单质能与足量浓硝酸反应 放出NO2气体 若参加反应的金属单质与硝酸的物质的量之比为1:a 则该
某金属单质能与足量浓硝酸反应,放出NO2气体,若参加反应的金属单质与硝酸的物质的量之比为1:a,则该金属元素在反应后生成的硝酸盐中的化合价是A.+2aB
铜是生物体必需的微量元素 也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的
铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。(1)写出铜与稀硝酸反应的化学方程式:
向一定量的Fe FeO和Fe2O3的混合物中加入120 mL 4 mol·L-1的稀硝酸 恰好使混合
向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1 344 L NO(标准状况),往所得溶液中加入KSCN溶液












