许多硫的含氧酸盐在医药 化工等方面有着重要的用途。(1)重晶石(BaSO4)常做胃肠道造影剂。已知:
| 许多硫的含氧酸盐在医药、化工等方面有着重要的用途。 (1)重晶石(BaSO4)常做胃肠道造影剂。 已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= __。 (2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。 ①检验晶体中含有NH4+的方法为 。 ②等物质的量浓度的四种稀溶液: a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4) 2SO4 d.(NH4)2SO3, 其中c(NH4+)由大到小的顺序为 __(填选项字母)。 (3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。 ①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 __。 ②用铂做电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为 __,电解过程中阴极附近溶液的pH将 __(填“增大”“减小”或“不变”)。 ③产品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 __为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该产品中K2S2O8的质量分数为(杂质不参加反应) __(列式并计算)。 |
参考解答
| (1)2.2×10-8mol/L (2)①取少量晶体,加水溶解,再加入足量NaOH浓溶液加热,生成能使湿润的红色石蕊试纸变蓝的气体,则有NH4+ ②a>c>d>b (3)①5S2O82-+2Mn2++8H2O  10SO42-+2MnO4-+16H+ 10SO42-+2MnO4-+16H+②2SO42--2e-=S2O82-(或2HSO4--2e-=S2O82-+2H+) 增大 ③淀粉 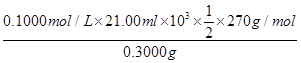 ×100%=94.50% |
(1)Ksp=c(Ba2+)·c(SO42-),所以c(Ba2+)=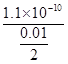 mol/L=2.2×10-8mol/L。(2)②因等物质的量浓度,所以b最小,a相互抑制的双水解、c单水解、d相互促进的双水解,所以c(NH4+):a>c>d>b。(3)①溶液变为紫色说明生成了MnO4-;②阳极失电子化合价升高:2SO42--2e-=S2O82-,阴极H+放电,水的电离平衡正向移动,c(OH-)增大;③K2S2O8具有强氧化性可以将I-氧化为I2,所以指示剂选择淀粉,由S2O82-+2I-=2SO42-+I2和I2+2S2O32-=2I-+S4O62-,得关系n(S2O82-)~2n(S2O32-)。 mol/L=2.2×10-8mol/L。(2)②因等物质的量浓度,所以b最小,a相互抑制的双水解、c单水解、d相互促进的双水解,所以c(NH4+):a>c>d>b。(3)①溶液变为紫色说明生成了MnO4-;②阳极失电子化合价升高:2SO42--2e-=S2O82-,阴极H+放电,水的电离平衡正向移动,c(OH-)增大;③K2S2O8具有强氧化性可以将I-氧化为I2,所以指示剂选择淀粉,由S2O82-+2I-=2SO42-+I2和I2+2S2O32-=2I-+S4O62-,得关系n(S2O82-)~2n(S2O32-)。点拨:本题考查离子反应,考查考生综合分析问题的能力。难度中等。 |
相似问题
工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是A.若管道漏气
工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是A.若管道漏气遇氨就会产生白烟B.该反应利用了Cl2的强氧化性C.该反应NH3被
弱电解质的电离平衡 盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。Ⅰ.已知H2A在水中存在以下平衡
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。Ⅰ 已知H2A在水中存在以下平衡:H2A=H++HA-,HA-H++A2-。(1)常温下
(4分) 实验室可以用高锰酸钾和浓盐酸反应制取氯气 反应的化学方程式如下2KMnO4+16HCl(浓
(4分) 实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O(1)在该反应中,还原剂是。(2
草酸亚铁(FeC2O4)常用作分析剂 显影剂以及新型电池材料磷酸亚铁锂的生产。I.某兴趣小组对草酸亚
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。I.某兴趣小组对草酸亚铁的分解产物进行实验和探究。(1)已知CO能与氯化钯
下表有三组物质 每组均有甲 乙 丙三种物质(酸碱盐均为溶液)第一组第二组第三组甲BaCl2NaOHC
下表有三组物质,每组均有甲、乙、丙三种物质(酸碱盐均为溶液)第一组第二组第三组甲BaCl2NaOHCu(NO3)2乙Fe2O3K2SO4H2SO4丙MgFeMgCl2(1)第二组中___












