弱电解质的电离平衡 盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。Ⅰ.已知H2A在水中存在以下平衡
| 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。 Ⅰ.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-H++A2-。 (1)常温下NaHA溶液的pH________(填序号),原因是_________________。 A.大于7 B.小于7 C.等于7 D.无法确定 (2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。 A.c(H+)·c(OH-)=1.0×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-) C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol·L-1 (3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。 A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体 Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理: 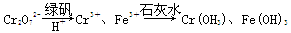 (1)该废水中加入绿矾和H+,发生反应的离子方程式为____________________。 (2)若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31) |
参考解答
| Ⅰ.(1)B NaHA只能发生电离,不能发生水解 (2)BC (3)BD Ⅱ.(1)Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O (2)3.0×10-6mol·L-1 |
| H2A在水中的一级电离进行完全,则HA-不水解只电离,故NaHA溶液呈酸性。HA-在水中部分电离,0.1 mol·L-1的NaHA溶液中c(H+)小于0.1 mol·L-1,加入0.1 mol·L-1KOH溶液至溶液呈中性时消耗的KOH溶液体积小于NaHA溶液体积,则混合溶液中c(Na+)>c(K+);由电荷守恒知,c(Na+)+c(K+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),且c(H+)=c(OH-),则c(Na+)+c(K+)=c(HA-)+2c(A2-);水的离子积与温度有关;混合液中c(Na+)>0.05 mol·L-1;降温、增大c(A2-)都能使平衡CaA(s)Ca2+(aq)+A2-(aq)左移。废水中加入绿矾和H+,根据流程图,可知发生的是氧化还原反应,配平即可。c(Cr3+)/c(Fe3+)=[c(Cr3+)·c3(OH-)/[c(Fe3+)·c3(OH)-=Ksp[Cr(OH)3/Ksp[Fe(OH)3=1.5×10-7,故c(Cr3+)=3.0×10-6 mol·L-1。 |
相似问题
(4分) 实验室可以用高锰酸钾和浓盐酸反应制取氯气 反应的化学方程式如下2KMnO4+16HCl(浓
(4分) 实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O(1)在该反应中,还原剂是。(2
草酸亚铁(FeC2O4)常用作分析剂 显影剂以及新型电池材料磷酸亚铁锂的生产。I.某兴趣小组对草酸亚
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。I.某兴趣小组对草酸亚铁的分解产物进行实验和探究。(1)已知CO能与氯化钯
下表有三组物质 每组均有甲 乙 丙三种物质(酸碱盐均为溶液)第一组第二组第三组甲BaCl2NaOHC
下表有三组物质,每组均有甲、乙、丙三种物质(酸碱盐均为溶液)第一组第二组第三组甲BaCl2NaOHCu(NO3)2乙Fe2O3K2SO4H2SO4丙MgFeMgCl2(1)第二组中___
铜单质及其化合物是应用极其广泛的物质。(1)铜是氢后金属 不能与盐酸发生置换反应 但将单质铜置于浓氢
铜单质及其化合物是应用极其广泛的物质。(1)铜是氢后金属,不能与盐酸发生置换反应,但将单质铜置于浓氢碘酸中,会有可燃性气体及白色沉淀生成,又知氧化
氢化亚铜(CuH)是一种难溶物质 用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。Cu
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸












