工业上采用硫化钠-石灰铁盐法处理高砷废水(砷的主要存在形式为H3AsO3)取得了很好的效果.实现了废
工业上采用硫化钠-石灰铁盐法处理高砷废水(砷的主要存在形式为H3AsO3)取得了很好的效果.实现了废水处理过程的“三废”零排放.其主要工艺流程如下: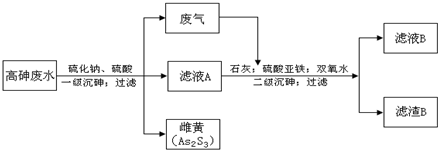 已知:①亚砷酸(H3AsO3)还原性较强,易被氧化为砷酸(H3AsO4) ②亚砷酸盐的溶解性大于相应的砷酸盐[如Ksp(FeAsO3)>Ksp(FeAsO4)] 请回答以下问题: (1)废气的主要成分为______,通过与石灰发生______反应(填基本反应类型)被吸收. (2)写出一级沉砷过程中生成雌黄的离子方程式:______. (3)滤液A中,除了有Na2SO4、H2SO4以外,还有溶质______. (4)二级沉砷过程中使用双氧水的目的有______. A.将三价砷氧化为五价砷,以提高除砷效果 B.将Fe2+氧化可生成Fe(OH) 3沉淀,以加速悬浮物的沉降 C.作绿色氧化剂,不引进新的杂质 (5)过滤操作常用的玻璃仪器有:______ (6)滤渣B的主要成分有______(写两种,用化学式表示). |
参考解答
| (1)在废水中加入硫化钠和硫酸,发生:S2-+2H+=H2S↑,H2S为酸性气体,与碱发生中和反应或复分解反应, 故答案为:H2S;中和反应(或复分解反应); (2)反应物为H3AsO3、硫化钠和硫酸,生成物为As2S3,则反应的离子方程式为2H3AsO3+3S2-+6H+=As2S3↓+6H2O或 2H3AsO3+3S2-=As2S3↓+6OH-;H++OH-=H2O, 故答案为:2H3AsO3+3S2-+6H+=As2S3↓+6H2O(或 2H3AsO3+3S2-=As2S3↓+6OH-;H++OH-=H2O); (3)当硫化钠不足,硫酸过量时,还可能有为反应的H3AsO3,故答案为:H3AsO3; (4)双氧水具有氧化性,为绿色氧化剂,能将三价砷氧化为五价砷,易于生成FeAsO4沉淀而除去,将Fe2+氧化可生成Fe(OH) 3沉淀,以加速悬浮物的沉降,故答案为:A B C; (5)过滤时用到的仪器有铁架台、玻璃棒、漏斗、滤纸以及烧杯,其中玻璃仪器有漏斗、烧杯、玻璃棒, 故答案为:漏斗、烧杯、玻璃棒; (6)加入双氧水,可将三价砷氧化为五价砷,将Fe2+氧化可生成Fe3+,由于亚砷酸盐的溶解性大于相应的砷酸盐, 可生成FeAsO4、Ca3(AsO4)2、Fe(OH) 3、CaSO4、还可能存在少量Ca3(AsO3)2, 故答案为:FeAsO4、Ca3(AsO4)2、Ca3(AsO3)2、Fe(OH) 3、CaSO4等. |
相似问题
在氧化还原反应的过程中 氧化反应和还原反应同时发生 有关SO2-2e-+2H2O→SO42-+4H+
在氧化还原反应的过程中,氧化反应和还原反应同时发生,有关SO2-2e-+2H2O→SO42-+4H+反应的说法错误的是( )A.该反应为氧化反应B.上述反应中若产生
已知氢化锂(LiH)属于离子化合物.LiH跟水反应可以放出氢气.下列叙述中正确的是( )A.LiH
已知氢化锂(LiH)属于离子化合物.LiH跟水反应可以放出氢气.下列叙述中正确的是( )A.LiH的水溶液显中性B.LiH中的氢离子可以被还原生成氢气C.Li
下列判断中一定正确的是( )A.等物质的量的CaCl2及CaO2固体中阴 阳离子数之比均为2:1B
下列判断中一定正确的是( )A.等物质的量的CaCl2及CaO2固体中阴、阳离子数之比均为2:1B.等质量的O2与O3中,氧原子的个数比为3:2C.分别用H2O2、K
在稀硫酸中 KMnO4和H2O2能发生氧化还原反应:氧化反应:H2O2-2e-═2H++O2↑还原反
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:氧化反应:H2O2-2e-═2H++O2↑还原反应:MnO-4+5e-+8H+═Mn2++4H2O(1)写出该氧化还原反应的离子方程式:_
在反应MnO2+4HCl=MnCl2+Cl2+2H2O中 氧化剂是:______ 还原剂是:____
在反应MnO2+4HCl=MnCl2+Cl2+2H2O中,氧化剂是:______,还原剂是:______,被氧化的物质是:______,发生还原反应的物质是:______.氧化产物是______,












