在2FeCl3+2KI═2FeCl2+2KCl+I2反应中:(1)______元素被氧化 _____
| 在2FeCl3+2KI═2FeCl2+2KCl+I2反应中: (1)______元素被氧化,______是还原产物 (2)该反应的离子方程式为:______ (3)FeCl3的氧化性______I2的氧化性(填“>”、“<”). (4)请用“双线桥法”标出该反应电子转移的方向和数目. |
参考解答
| (1)在2FeCl3+2KI═2FeCl2+2KCl+I2反应中,碘元素化合价从-1价变化为0价,化合价升高时做还原剂,KI被氧化发生氧化反应,铁元素化合价从+3价降低到+2价,化合价降低做氧化剂,被还原得到还原产物FeCl2,故答案为:I;FeCl2; (2)该反应的离子方程式为:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2; (3)氧化还原反应中的氧化剂FeCl3的氧化性大于氧化产物I2,故答案为:>; (4)铁元素化合价从+3价变化为+2价得到电子;碘元素化合价从-1价变化为0价,用双线桥标注电子转移: 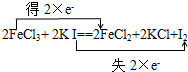 , 故答案为: 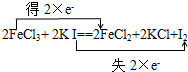 . |
相似问题
已知常温下可用Co2O3制备Cl2 反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2 H+ Cl-和
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+、Cl-和Co2+.下列叙述不正确的是( )A.氧化产物为Cl2B.氧化剂与还原剂的
某含铬Cr2O2-7废水用硫酸亚铁铵[FeSO4?(NH4)2SO4?6H2O]处理 反应中铁元素和
某含铬Cr2O2-7废水用硫酸亚铁铵[FeSO4?(NH4)2SO4?6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀干燥后得到nmolFeO?FeyCrxO3.不考虑处理过程
在反应:3BrF3+5H2O=HBrO3+Br2+9HF十O2中(F为-1价)(1)此反应中被氧化的
在反应:3BrF3+5H2O=HBrO3+Br2+9HF十O2中(F为-1价)(1)此反应中被氧化的元素是______、被还原的元素是______.(2)当有5mol水参加反应时,被氧化的水
在H2O2溶液中加入KI和H2SO4的混合溶液 迅速发生反应 放出大量气体 反应过程可表示如下:①H
在H2O2溶液中加入KI和H2SO4的混合溶液,迅速发生反应,放出大量气体,反应过程可表示如下:①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;②H2O2+I2=2HIO;③H2O2+2HI
关于氧化还原反应的说法中正确的是( )A.金属单质常作为还原剂B.非金属单质只能做氧化剂C.作氧化
关于氧化还原反应的说法中正确的是( )A.金属单质常作为还原剂B.非金属单质只能做氧化剂C.作氧化剂的物质不能作还原剂D.化合价降低,失去电子的












