反应 (1)请用双线桥标出反应中电子转移的情况。(3分)(2)若有19.2g Cu被氧化 则被还原
反应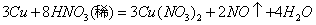 , ,(1)请用双线桥标出反应中电子转移的情况。(3分) (2)若有19.2g Cu被氧化,则被还原的HNO3的质量为多少?(7分) |
参考解答
(1)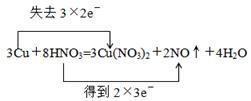 (2)12.6g (2)12.6g |
试题分析:(1)根据反应的化学方程式可知,在反应中铜的化合价从0价升高到+2价,失去个电子。硝酸中氮元素的化合价从+5价降低到+2价,得到3个电子,所以用双线桥标出反应中电子转移的情况是 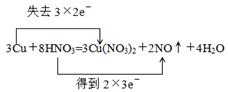 。 。(2)19.2g铜到物质的量是19.2g÷64g/mol=0.3mol 则被还原的硝酸是 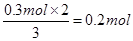 质量是0.2mol×63g/mol=12.6g 点评:该题是中等难度的试题,试题基础性强,侧重能力的培养和解题方法的指导与训练。试题难易适中,贴近高考,有助于培养学生的逻辑思维能力和发散思维能力,提高学生的规范答题能力和应试能力。 |
相似问题
(4分)⑴24 mL 0.05 mol·L-1的Na2SO3溶液恰好被20 mL 0.02 mol·
(4分)⑴24 mL 0 05 mol·L-1的Na2SO3溶液恰好被20 mL 0 02 mol·L-1的K2R2O7溶液氧化,则元素R在还原产物中的化合价是________。⑵将0 64 g
a mol FeS与b mol FeO投入到v L c mol?L-1的硝酸溶液中充分反应 产生NO
a mol FeS与b mol FeO投入到v L、c mol?L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4 而NaClO被还原为NaCl 若反应中Na
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x值是A.2B.3C.4D.5
若锌与稀硝酸反应时 其化学反应方程式为 则a b c M可能分别为( )A.4 1 5 N2OB
若锌与稀硝酸反应时,其化学反应方程式为,则a、b、c、M可能分别为()A.4、1、5、N2OB.4、2、4、NO2C.4、1、3、NH4NO3D.4、3、5、NO
用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+C
用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ mol②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)












